题目内容
下列从混合物中分离出其中的一种成分,所采取的分离方法正确的是 ( )
| A.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| B.水的沸点为100oC,酒精的沸点为78.5oC,所以可用加热蒸馏方法,使含水的酒精变为无水酒精 |
| C.四氯化碳和水混合后,可用分液的方法来分离 |
| D.NaCl溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl溶液中分离得到纯净的NaCl |
C
解析试题分析:酒精和水可以以任意比互溶,故无法用酒精把碘水中的碘萃取出来,A项错误。水可以和乙醇形成共沸溶液,少量的水没法除掉,B项错误。四氯化碳和水不互溶,可以实现分液分离,C项正确。NaCl的溶解度虽然随着温度的下降而减少但是减少的幅度实在太小了,基本不变,所以不能大量析出,不能用冷却热饱和溶液的方法分离NaCl这种只能蒸发结晶,D项错误。
考点:物质的分离

练习册系列答案
相关题目
离子检验的常用方法有三种:
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
A.NH4+-气体法 B.I--沉淀法
C.Fe3+-显色法 D.Ca2+-气体法
下列除杂质(括号内为杂质)方法不合理的是( )
| A.Fe2+(Fe3+),加过量铁粉,过滤 |
| B.Mg(Al),加过量NaOH溶液,过滤 |
| C.(HCl),过量饱和,洗气 |
| D.食盐(碘),加热,升华 |
如图,在盛有碘水的三支试管中分别加入苯(密度比水小,不溶于水)、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论有( )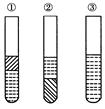
| A.①加入的是CCl4,②是苯,③加酒精 |
| B.①加入的是酒精,②加CCl4,③加苯 |
| C.①加入的是苯,②加CCl4,③加酒精 |
| D.①加入的是苯,②加酒精,③加CCl4 |
以下是对某溶液进行离子检验的方法和结论,其中正确的是( )
| A.先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
| B.加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32- |
| C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| D.先加适量的硝酸将溶液酸化,再加入AgNO3溶液,产生白色沉淀,则溶液中一定含有大量的Cl— |
已知丙酮通常是无色的液体,与水互溶,密度小于1 g/mL ,沸点约为55℃。要将水与丙酮分离出来,选择的方法是( )
| A.蒸馏 | B.分液 | C.过滤 | D.蒸发 |
下列实验操作正确的是( )
| A.蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的溶液中 |
| B.过滤操作时,玻璃棒应靠在三层滤纸的一侧 |
| C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| D.分液操作时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 |
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 滴入稀HNO3同时用pH试纸测定至溶液呈中性 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉充分反应并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | BaSO4 | BaCO3 | 加盐酸溶解、过滤、洗涤、干燥 |
A.①②③ B.②③④ C.①③④ D.①②③④
对下列各组物质进行区别的实验方案(见括号内)不妥的是
| A.溴水和碘水(淀粉溶液) |
| B.硫酸铵与氯化铵(采用加碱加热闻其气味的方法) |
| C.NaCl与KCl(采用灼烧观察焰色的方法) |
| D.K2CO3与KNO3(采用加盐酸观察其是否有气泡产生的方法) |