��Ŀ����
4������ȼ�ϵ��������������ȼ�ϵ����������ʵ������Ⱦ�ŷţ�����ϵͳ������������������ȡ֮��������֮���ߣ�ȼ�ϵ��������Ϊ������������ҵ��ע�Ľ��㣮Ϊ�˻�þ������ƣ������׳�̨���ߣ������ƽ�ȼ�ϵ�عؼ��������з���ȼ�ϵ�ص�ȼ�����������״������͵ȣ���1��������̼�ǵ�������ЧӦ��������ף�Ŀǰ���Ǵ���������̼�ķ���֮һ��ʹ����������Ӧ�ϳɼ״����״�������ȼ�ϵ�ص���Ҫȼ�ϣ���֪�������״�ȼ�յ��Ȼ�ѧ����ʽ���£�
2H2��g��+O2 ��g��=2H2O ��l����H=-571.6kJ•mol-1 ��
CH3OH��l��+$\frac{3}{2}$O2��g����CO2��g��+2H2O��l����H=-726.0kJ•mol-1 ��
д��������̼�������ϳɼ״�Һ����Ȼ�ѧ����ʽ��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-131.4kJ•mol-1��
��2���пƼ�����������ϡ��������������Ϊ��������������˼״�һ����ȼ�ϵ�أ�����ϡ�������������ڸ������ܴ���O2-��
�ٵ�����������ķ�Ӧ��O2+4e-=2O2-��
���������ķ�Ӧ��CH2OH+4O2--8e-=CO2+2H2O��
����ϡ������������Ĺ��������У�O2-���ƶ������Ǵ�����������
�ۼ״���������ȼ����ȼ��ֱ�Ӳ��������ƶ����������У����Ƽ�������ȴҪ���Ѵ����ľ����о��״�ȼ����������Ҫԭ���ǣ�ȼ�ϵ�ص�����ת���ʸߣ�
���� ��1��2H2��g��+O2 ��g��=2H2O ��l����H=-571.6kJ•mol-1 ��
2CH3OH��l��+3O2��g����2CO2��g��+4H2O��l����H=-726.0kJ•mol-1 ��
���ݸ�˹���ɢ١�3-�ڵõ���2CO2 ��g��+6H2 ��g��=2CH3OH��l��+2H2O ��l�����ݸ�˹���ɼ����ʱ䣬������д�Ȼ�ѧ����ʽ��
��2����ȼ�ϵ��������ԭ��ع���ԭ���������������õ����ӷ�����ԭ��Ӧ��������ǹ��壬�����õ��������������ӣ��״��ڸ���ʧ���ӷ���������Ӧ���ɶ�����̼��
��ԭ�����������������
������ԭ��ط�Ӧ����ת���ʸ߷����жϣ�
��� �⣺��1��2H2��g��+O2 ��g��=2H2O ��l����H=-571.6kJ•mol-1 ��
2CH3OH��l��+3O2��g����2CO2��g��+4H2O��l����H=-726.0kJ•mol-1 ��
���ݸ�˹���ɢ١�3-�ڵõ���2CO2 ��g��+6H2 ��g��=2CH3OH��l��+2H2O ��l����H=-262.8kJ•mol-1��
�Ȼ�ѧ����ʽΪ��CO2 ��g��+3H2 ��g��=CH3OH��l��+H2O ��l����H=-131.4 kJ•mol-1��
�ʴ�Ϊ��CO2 ��g��+3H2 ��g��=CH3OH��l��+H2O ��l����H=-131.4 kJ•mol-1��
��2���ټ״�һ����ȼ�ϵ���������õ����ӷ�����ԭ��Ӧ���������ӣ��缫��ӦΪ��O2+4e-=2O2-�� �״��ڸ���ʧ���ӷ���������Ӧ���缫��ӦΪ��CH3OH+4O2--8e-=CO2+2H2O��
�ʴ�Ϊ��O2+4e-=2O2-�� CH3OH+4O2--8e-=CO2+2H2O��
�����ݵ缫��Ӧ������֪ԭ����������������������Ӵ����������ƶ���
�ʴ�Ϊ��������������
��ԭ��ط�Ӧʵ������ת���ĸ�Ч�ʣ�ȼ�ϵ������ת���ʸߣ�
�ʴ�Ϊ��ȼ�ϵ�ص�����ת���ʸߣ�
���� ���⿼�����Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�ã�ԭ���ԭ�������жϣ��缫��Ӧ��д������ע�������ǹ��壬��Ŀ�Ѷ��еȣ�

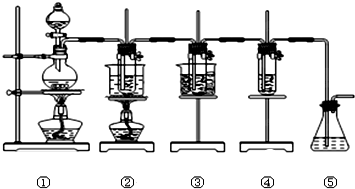 ��ʵ�����������ͼ��ʾװ������ȡ�����ơ��������ƺ�̽����ˮ�����ʣ� ��ͼ�У�
��ʵ�����������ͼ��ʾװ������ȡ�����ơ��������ƺ�̽����ˮ�����ʣ� ��ͼ�У���Ϊ��������װ�ã�
�ڵ��Թ���ʢ��15mL 30% NaOH��Һ����ȡ�����ƣ���������ˮԡ�У�
�۵��Թ���ʢ��15mL 8% NaOH��Һ����ȡ�������ƣ������ڱ�ˮԡ�У�
�ܵ��Թ��������ɫʯ����Һ��
��Ϊβ������װ�ã�����д���пհף�
��1����ȡ����ʱ������ƿ�����һ�����Ķ������̣�ͨ����Һ©������д�������ƣ�����ƿ�м���������Ũ���ᣮʵ������Cl2�Ļ�ѧ����ʽMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
ʵ��ʱΪ�˳�ȥ�����е�HCl���壬���ڢ����֮�䰲װʢ��C����д���б����ĸ���ľ���װ�ã�
A����ʯ�� B������������Һ C������ʳ��ˮ D��Ũ����
��2���������������������20mL 12mol•L-1��Ũ�����ϼ��ȣ���ַ�Ӧ�����ɵ�����
С�� 0.06mol��������ڡ���С�ڡ������ڡ���������17.4g��MnO2����ԭ����������HCl����Ϊ142g��
��3���Ƚ���ȡ�����ƺʹ������Ƶ����������ߵIJ����Ǣ�����NaOHŨ�Ȳ�ͬ���ڷ�Ӧ���Ƶ��¶Ȳ�ͬ��
��4��ʵ���пɹ۲쵽�ܵ��Թ�����Һ����ɫ���������±仯������д����еĿհף�
| ʵ������ | ԭ�� |
| ��Һ�������ɫ��Ϊ��ɫ | ������ˮ��Ӧ���ɵ�H+ʹʯ���ɫ |
| �����Һ��Ϊ��ɫ | HClO��ǿ�����ԣ�����Ư������������ɫ |
| Ȼ����Һ����ɫ��Ϊ��Һ��ɫ��Ϊdz��ɫɫ | ��Һ���ܽ��˴���������������dz��ɫ |
| A�� | A��ƽ����������Ϊ0.32mol•L-1•min-1 | |
| B�� | B��ת����Ϊ80% | |
| C�� | x��ֵΪ2 | |
| D�� | B��ƽ��Ũ��Ϊ1mol•L-1 |
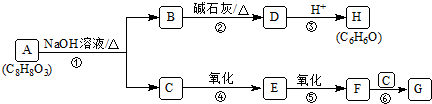
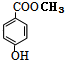 ��
�� ��
��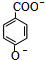 +CH3OH+H2O��
+CH3OH+H2O�� ���÷�Ӧ���������ۣ�
���÷�Ӧ���������ۣ� ��
��