题目内容
17.根据酸碱的质子理论,“凡是能给出质子[H+]的分子或离子都是酸;凡是能结合质子的分子或离子都是碱.”按这个理论,下列微粒:①HS-,②CO32-,③HPO42-,④NH3,⑤OH-,⑥H2O,⑦HCO3-,⑧HAc,⑨KHSO4
(1)只属于碱的微粒是:CO32-,NH3,OH-;;
(2)属于两性的微粒是:①③⑥⑦.(填编号).
分析 (1)凡是能给出质子[H+]的分子或离子都是酸,凡是能结合质子的分子或离子都是碱,②④⑤;
(2)所给微粒中既能结合H+又能提供H+的有HS-、HPO42-、H2O和HCO3-,因此这四种物质从酸碱质子理论的角度上看既是酸又是碱,即两性物质.
解答 解:(1)根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱,质子就是氢离子.
凡是能结合质子的分子或离子都是碱,CO32-,NH3,OH-,
故答案为:CO32-,NH3,OH-;
(2)所给微粒中既能结合H+又能提供H+的有HS-、HPO42-、H2O和HCO3-,因此这四种物质从酸碱质子理论的角度上看既是酸又是碱,即两性物质.
属于两性的微粒是①③⑥⑦,
故答案为:①③⑥⑦.
点评 本题考查酸碱质子理论的理解应用,酸、碱、两性物质的概念,难度不大,注意根据题目所给信息解题.

练习册系列答案
相关题目
7.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 苯(液溴):加入NaOH溶液,分液 |
5.某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( )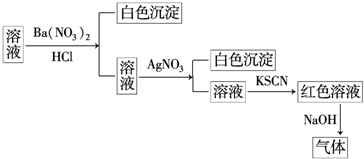

| A. | 原溶液中一定含有SO42- | B. | 原溶液中一定含有NH4+ | ||
| C. | 原溶液中一定含有Cl- | D. | 原溶液中一定含有Fe3+ |
12.某烃的一种同分异构体,核磁共振氢谱测得分子中只有一个吸收峰,则该烃的分子式可能为( )
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
6.下列物质中,含有非极性共价键的是( )
| A. | 甲烷 | B. | 氯化钠 | C. | 过氧化钠 | D. | 氯化铵 |
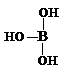 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题: .
. .
.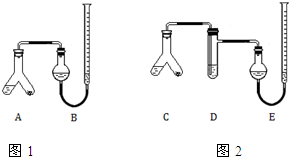 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
 .
.