题目内容
18.有M、N、P、Q四块金属片,进行如下实验:①M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗
②P、Q用导线相连后,同时浸入稀H2SO4中,Q是电子流入的一极
③M、P相连后,同时浸入稀H2SO4,P极产生大量气泡
④N、Q相连后,同时浸入稀H2SO4中,Q极发生氧化反应
则四种金属的活动性顺序为( )
| A. | M>N>P>Q | B. | M>P>Q>N | C. | N>Q>P>M | D. | P>M>N>Q |
分析 一般来说,在原电池中,较活泼的金属作负极、较不活泼的金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,电子从负极沿导线流向正极,据此判断金属活动性强弱.
解答 解:一般来说,在原电池中,较活泼的金属作负极、较不活泼的金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,电子从负极沿导线流向正极,
①M、N用导线相连后,同时插入硫酸铜溶液中,N极变粗,则N电极上铜离子得电子生成Cu,为原电池正极,所以金属活动性M>N;
②P、Q用导线相连后,同时浸入稀H2SO4中,Q是电子流入的一极,电子流出的电极是负极、电子流入的电极是正极,所以金属活动性P>Q;
③M、P相连后,同时浸入稀H2SO4,P极产生大量气泡,P电极上氢离子得电子发生还原反应生成氢气,则P是正极,金属活动性M>P;
④N、Q相连后,同时浸入稀H2SO4中,Q极发生氧化反应,则Q为负极、N为正极,金属活动性Q>N;
通过以上分析知,金属活动性强弱顺序是M>P>Q>N,
故选B.
点评 本题以原电池原理为载体考查金属活动性强弱判断,明确原电池正负极判断方法是解本题关键,明确各电极反应类型、发生的反应及电子和电流流向即可解答,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
6. 已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
 已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )
已知:3CH4(g)+2N2(g)?3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如图所示,下列说法不正确的是( )| A. | n(CH4)/n(N2)越小,CH4的转化率越高 | |
| B. | n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 | |
| C. | b点对应的平衡常数与a点一样 | |
| D. | a点对应的NH3的体积分数约为26% |
13.同位素示踪法可用于反应机理的研究.下列反应同位素示踪表示正确的是( )
| A. | 2CH3CH2OH+${\;}_{\;}^{18}$O2$→_{□}^{Cu}$2CH3CH${\;}_{\;}^{18}$O+2H2O | |
| B. | CH3COOC2H5+H2${\;}_{\;}^{18}$O$→_{□}^{H+}$CH3COOH+CH3CH2${\;}_{\;}^{18}$OH | |
| C. | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4=K2SO4+2KMnSO4+5${\;}_{\;}^{18}$O2↑+8H2O | |
| D. | 2Na2${\;}_{\;}^{18}$O2+2H2O=4Na${\;}_{\;}^{18}$OH+O2↑ |
3.可逆反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下反应速率分别如下,其中反应速率最大的是( )
| A. | v(A)=0.25 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v (C)=0.3 mol/(L•min) | D. | v(D)=0.1 mol/(L•min) |
10.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 苯酚能与氢氧化钠反应而乙醇不能 |
7.下列各化合物的命名正确的是( )
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | B. |  3-丁醇 3-丁醇 | ||
| C. | 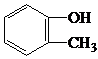 甲基苯酚 甲基苯酚 | D. | 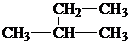 2-甲基丁烷 2-甲基丁烷 |
8.下列不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 非金属性:F>O>S |
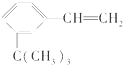 有如下性质:
有如下性质: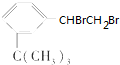 .
.