题目内容
【题目】下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法正确的是
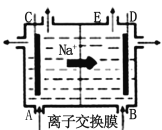
A.从E口逸出的气体是 Cl2
B.每生成 22.4 L Cl2,同时产生2 mol NaOH
C.从B口加入含少量NaOH的水溶液以增强导电性
D.依次用Na2CO3、NaOH、BaCl2、盐酸等试剂除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子
【答案】C
【解析】
A.右边是阴极区,发生2H++2e-=H2↑,所以从E口逸出的气体是H2,故A错误;
B. 每生成 22.4 L Cl2,没有指名温度和压强,故B错误;
C.阴极生成OH-,且Na+向阴极移动,阴极区生成NaOH,为增强导电性,则从B口加入稀NaOH(增强导电性)的水溶液,故C正确;
D.粗盐提纯所加试剂的顺序Na2CO3必须放在BaCl2的后面,故D错误;
故选:C。

【题目】化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如下(所取溶液体积均为2 mL):
实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
Ⅰ | 25 | 0.1 | 0.1 |
Ⅱ | 25 | 0.2 | 0.1 |
Ⅲ | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是______(填实验编号,下同)。
②为探究浓度对化学反应速率的影响,应选择______和______。
(2)某温度下,在1 L密闭容器中,发生反应:2X(g)+Y(g)![]() 2Z(g),X的物质的量随时间的变化如下表:
2Z(g),X的物质的量随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
X的物质的量/mol | 0.02 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
①用X的浓度变化表示0~2 s的平均化学反应速率为______mol/(L·s)。
②在3 s以后X的浓度不再改变,反应达到了______状态。
③能说明该反应已达到化学平衡状态的是______(填序号)。
A.v正(X)=v逆(X)
B.单位时间内有2 mol X生成同时有1 mol Y生成
C.X、Y、Z的分子数之比为2∶1∶2





