题目内容
【题目】下图是元素周期表的一部分,表中的①~⑧中元素,用元素符号或化学式填空回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ||||
四 | ⑧ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为___________。
(2)②元素的原子L层有______个电子,其最高价氧化物的化学式为________,气态氢化物的化学式为________,实验室制备其气态氢化物的化学方程式为__________。
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是_______,碱性最强的是______,呈两性的是__________________。
(5)写出①单质在空气中燃烧的化学方程式_______________________。
【答案】 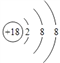 5 N2O5 NH3 2NH4Cl+Ca(OH)2
5 N2O5 NH3 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O HClO4 KOH Al(OH)3 Al HF 4Li+O2
CaCl2+2NH3↑+2H2O HClO4 KOH Al(OH)3 Al HF 4Li+O2![]() 2Li2O
2Li2O
【解析】分析:首先根据元素在周期表中的相对位置先判断出①~⑧的元素名称,然后结合元素周期律、相关的问题和有关物质的性质分析解答。
详解:根据元素在周期表中的相对位置可知①~⑧元素分别是Li、N、F、Al、S、Cl、Ar、K。则
(1)在这些元素中,化学性质最不活泼的原子是稀有气体元素Ar,Ar的原子序数是18,原子结构示意图为 。
。
(2)②元素是N,氮原子L层有5个电子,其最高价是+5价,因此最高价氧化物的化学式为N2O5,最低价是-3价,则气态氢化物的化学式为NH3,实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(3)非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高价氧化物水化物的碱性越强,O、F没有含氧酸,则这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3。
(4)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则③④⑤中原子半径最大的是Al。同主族从上到下氢化物的稳定性逐渐减弱,则③⑥的气态氢化物更稳定的是HF。
(5)Li单质在空气中燃烧的化学方程式为4Li+O2![]() 2Li2O。
2Li2O。




