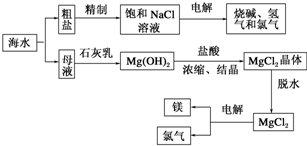
题目内容
18.在1~18号元素中,A、B、C、D为除稀有气体外的四种元素,它们的原子序数依次增大,其中只有C元素为金属元素,C的最外层电子数和A的相等;C、D两元素原子的质子数之和为A、B两元素原子质子数之和的3倍.(1)A为HB为OC为NaD为S(填元素符号).
(2)用电子式表示C与D形成C2D的过程
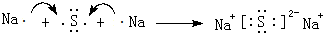 .
.
分析 在1~18号元素中,A、B、C、D为除稀有气体外的四种元素,它们的原子序数依次增大,C的最外层电子数和A的相等,二者同主族,其中只有C元素为金属元素,结合原子序数可知,C只能处于第三周期,则D也处于第三周期,B为非金属性,原子序数小于C,则B只能处于第二周期,C、D两元素原子的质子数之和最大为13+17=30,且为A、B两元素原子质子数之和的3倍,则A、B两元素原子的质子数之和最大为10,可推知A为H元素,则C为Na,故11+14≤C、D两元素质子数之和≤11+17,由于能被3整除,只能为27,故D为S元素,可推知B为O元素,据此解答.
解答 解:(1)在1~18号元素中,A、B、C、D为除稀有气体外的四种元素,它们的原子序数依次增大,C的最外层电子数和A的相等,二者同主族,其中只有C元素为金属元素,结合原子序数可知,C只能处于第三周期,则D也处于第三周期,B为非金属性,原子序数小于C,则B只能处于第二周期,C、D两元素原子的质子数之和最大为13+17=30,且为A、B两元素原子质子数之和的3倍,则A、B两元素原子的质子数之和最大为10,可推知A为H元素,则C为Na,故11+14≤C、D两元素质子数之和≤11+17,由于能被3整除,只能为27,故D为S元素,可推知B为O元素.
故答案为:H;O;Na;S;
(2)用电子式表示形成Na2S的过程为: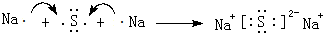 ,
,
故答案为: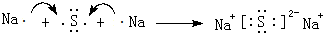 .
.
点评 本题考查结构性质位置关系应用,需要学生熟练掌握短周期元素,侧重考查学生分析推理能力,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列离子水解的离子方程式中正确的是( )
| A. | HCO3-+H2O?CO2↑+H2O+OH- | B. | HS-+H2O?H3O++S2- | ||
| C. | Fe3++3H2O?Fe(OH)3↓+3H+ | D. | CO32-+H2O?HCO3-+OH- |
7.常温下,把1mL 0.1mol/L的硫酸加水稀释制成2L溶液,在此溶液中由水电离产生的H+,接近于( )
| A. | 1.0×10-4 mol/L | B. | 1.0×10-8 mol/L | ||
| C. | 1.0×10-11 mol/L | D. | 1.0×10-10 mol/L |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 28 g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |