题目内容
【题目】含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1mol·L1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
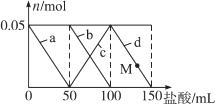
A. a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
【答案】D
【解析】
试题A、a曲线表示Na[Al(OH)4]和盐酸反应生成氢氧化铝和氯化钠的反应,所以发生反应的离子方程式为:[Al(OH)4]-+H+=Al(OH)3↓+H2O,故A正确;B、b曲线表示碳酸钠和盐酸反应,c曲线也表示碳酸钠和盐酸的反应,只是b曲线表示碳酸钠的物质的量,c曲线表示碳酸氢钠的物质的量,所以b和c曲线表示的离子反应是相同的,故B正确;C、因加50mL盐酸之后沉淀不溶解,则M点和50mL时相同,Na[Al(OH)4]中铝元素全部转化为氢氧化铝沉淀,设氢氧化铝的质量为X,
Na[Al(OH)4]+HCl=NaCl+Al(OH)3↓+H2O,
1mol 78g
1molL-1×0.05L XX=3.9g,故C正确;D、由图象知,Na2CO3、Na[Al(OH)4]的物质的量相等都是0.05mol,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与[Al(OH)4]-的物质的量之比,故D错误,故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目