题目内容
【题目】(1)已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH1 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH2
则 NH3(g)的标准燃烧热Δ H=__________________。
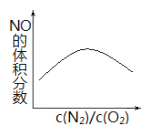
(2)高温下,N2(g)+O2(g)![]() 2NO(g), ΔH<0,反应达到平衡时混合气体中NO的体积分数与反应物中 c(N2)/c(O2)的比值的关系如图,请在右图上画出适当降温后,反应达到平衡时混合气体中 NO 的体积分数与反应物中 c(N2)/c(O2)的比值的关系图。_______
2NO(g), ΔH<0,反应达到平衡时混合气体中NO的体积分数与反应物中 c(N2)/c(O2)的比值的关系如图,请在右图上画出适当降温后,反应达到平衡时混合气体中 NO 的体积分数与反应物中 c(N2)/c(O2)的比值的关系图。_______
(3)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。
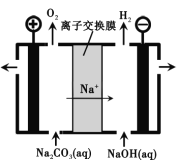
①电解的总反应式___________________________。
②已知H2CO3的Ka1=4.30×10-7, Ka2=5.60×10-11, 当同浓度的稀NaHCO3和稀Na2CO3溶液以2∶1体积比混合后,混合液的c(H+)约为____________ mol·L-1。
(4)为测定某NaNO2 溶液的物质的量浓度, 准确量取10.00mLNaNO2 溶液样品与24.00mL 0.05000mol·L-1 过量的酸性KMnO4 溶液充分反应,反应后所得溶液用0.1000mol/L(NH4)2Fe(SO4)2 标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2 溶液 10.00mL。 终点的现象_____________________,通过计算确定NaNO2 溶液的物质的量浓度___________ mol·L-1。
有关反应式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O; 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
【答案】 ΔH=(2ΔH1+3ΔH2)/20 kJ·mol-1 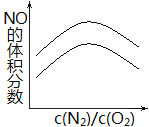 Na2CO3+H2O
Na2CO3+H2O![]() NaOH+NaHCO3 1.12×10-10mol·L-1 紫色刚好褪去,且半分钟内不变色 0.2500mol·L-1
NaOH+NaHCO3 1.12×10-10mol·L-1 紫色刚好褪去,且半分钟内不变色 0.2500mol·L-1
【解析】(1)①4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH1,② 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH2
根据盖斯定律,将①×2+②×3得:20NH3(g)+15O2(g)= 10N2(g)+30H2O(l) ΔH=(2ΔH1+3ΔH2) kJ·mol-1,则NH3(g)的标准燃烧热Δ H=(2ΔH1+3ΔH2)/20 kJ·mol-1,故答案为:(2ΔH1+3ΔH2)/20 kJ·mol-1;
(2)在相同的c(N2)/c(O2)条件下,降低温度,平衡正向移动,NO的体积分数增大,因此图像为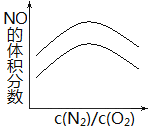 ,故答案为:
,故答案为: ;
;
(3)①根据图示,阳极区水电离的氢氧根离子放电生成氧气,剩余的氢离子与碳酸根离子反应生成碳酸氢根离子,阴极区溶液中水电离的氢离子放电生成氢气,剩余的氢氧根离子与转移过来的钠离子结合生成氢氧化钠,因此电解Na2CO3溶液可以生成NaHCO3和NaOH,同时电解水生成了氢气和氧气,则电解Na2CO3溶液的总反应式为Na2CO3+H2O![]() NaOH+NaHCO3,故答案为:Na2CO3+H2O
NaOH+NaHCO3,故答案为:Na2CO3+H2O![]() NaOH+NaHCO3;
NaOH+NaHCO3;
②同浓度的稀NaHCO3和稀Na2CO3溶液以2∶1体积比混合后溶液显碱性,以碳酸钠的水解为主,因为碳酸钠的水解平衡常数=![]() =
=![]() ×10-3 mol/L =
×10-3 mol/L =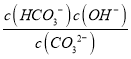 ≈
≈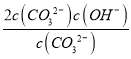 =2 c(OH-),因此c(OH-)=
=2 c(OH-),因此c(OH-)=![]() ×10-3 mol/L,则c(H+)=
×10-3 mol/L,则c(H+)=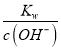 =1.12×10-10mol·L-1,故答案为:1.12×10-10mol·L-1;
=1.12×10-10mol·L-1,故答案为:1.12×10-10mol·L-1;
(4)滴定反应的方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,当紫色刚好褪去,且半分钟内不变色,说明达到了滴定终点;根据5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可知,与(NH4)2Fe(SO4)2 标准溶液反应的高锰酸钾为0.01L×0.1000mol/L×![]() =2×10-4mol,则与NaNO2 溶液反应的高锰酸钾为0.02400L×0.05000mol·L-1 -2×10-4mol=0.001mol,根据5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,NaNO2 溶液的物质的量浓度==0.25 mol·L-1,故答案为:紫色刚好褪去,且半分钟内不变色;0.2500mol·L-1。
=2×10-4mol,则与NaNO2 溶液反应的高锰酸钾为0.02400L×0.05000mol·L-1 -2×10-4mol=0.001mol,根据5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,NaNO2 溶液的物质的量浓度==0.25 mol·L-1,故答案为:紫色刚好褪去,且半分钟内不变色;0.2500mol·L-1。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】资料显示“O2 的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应。实验如下:
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2mL1mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2mL1mol/LKI 溶液+5滴淀粉+1mL0.1mol/L HCl | 溶液变蓝 | |
③2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol/L KCl | 无明显变化 | |
④2mL1mol/LKI溶液+5滴淀粉+1mL0.1mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
下列说法不正确的是
A. 通过小烧杯中溶液颜色的变化证明反应的发生
B. ③是验证Cl-是否影响KI与O2的反应
C. ④说明CH3COOH 是弱酸,因为和盐酸同浓度同温度的情况下,电离出 c(H+)浓度低
D. 此实验还可以增加2mL1mol/LKI溶液+5 滴淀粉+1mL0.1mol·L-1NaOH 溶液这一步骤