题目内容
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。己知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O

回答下列问题:
(1)甲装置中仪器a的名称是_________________,MnO2在反应中所起的作用是_____________。
(2)装置乙中饱和食盐水的作用是_________________。
(3)①制取漂白粉的化学方程式是____________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是____________________。
③为提高Ca(ClO)2的含量,可采取的措施是___________________(任写一种即可)。
(4)漂白粉应密封保存,原因是__________、_________________(用化学方程式表示)。
【答案】 分液漏斗 作氧化剂 除去氯气中混有的氯化氢 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 氯气和碱反应会放出热量,导致温度升髙,发生了副反应:6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O 将丙装置浸在盛有冷水的水槽中或控制氯气产生速率(其它合理答案也给分) Ca(ClO)2+CO2+H2O= CaCO3+2HClO 2HClO
5CaCl2+Ca(ClO3)2+6H2O 将丙装置浸在盛有冷水的水槽中或控制氯气产生速率(其它合理答案也给分) Ca(ClO)2+CO2+H2O= CaCO3+2HClO 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】(1)甲装置中仪器a具有球形特征,有玻璃活塞,在该实验中,可以控制加入的浓盐酸,为分液漏斗,装置A制取Cl2,反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应中Mn元素化合价降低(+4→+2),MnO2为氧化剂;(2)浓盐酸和二氧化锰反应过程中会挥发出氯化氢气体,氯化氢在氯化钠饱和溶液中易溶,而氯气难溶,通过饱和食盐水的作用是除去Cl2中混有的HCl气体;(3)①漂白粉的主要成分是次氯酸钙和氯化钙,将氯气通入石灰乳制取漂白粉,同时有水生成,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;②氯气和碱反应会放出热量,导致温度升高,当温度低时,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;当温度高时,发生了副反应:6Cl2+6Ca(OH)2
MnCl2+Cl2↑+2H2O,反应中Mn元素化合价降低(+4→+2),MnO2为氧化剂;(2)浓盐酸和二氧化锰反应过程中会挥发出氯化氢气体,氯化氢在氯化钠饱和溶液中易溶,而氯气难溶,通过饱和食盐水的作用是除去Cl2中混有的HCl气体;(3)①漂白粉的主要成分是次氯酸钙和氯化钙,将氯气通入石灰乳制取漂白粉,同时有水生成,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;②氯气和碱反应会放出热量,导致温度升高,当温度低时,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;当温度高时,发生了副反应:6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2];③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时升高;(4)漂白粉有效成分为次氯酸钙,HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,受空气中的水、CO2作用而导致变质,生成CaCO3和HClO,次氯酸不稳定,见光易分解,该反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO、2HClO
5CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2];③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时升高;(4)漂白粉有效成分为次氯酸钙,HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,受空气中的水、CO2作用而导致变质,生成CaCO3和HClO,次氯酸不稳定,见光易分解,该反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO、2HClO![]() 2HCl+O2↑,所以漂白粉应密封保存。
2HCl+O2↑,所以漂白粉应密封保存。

【题目】已知:O2(g)+2H2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
C(s,石墨)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJmol﹣1
(1)请写出CO与水蒸汽反应的热化学方程式
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)= , 请计算此时的平衡常数K= . 
时间/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于状态;c1数值0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因(填字母),表中5min~6min之间数值发生变化,可能的原因是 . (填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
【题目】完成下列问题:
(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
①滴定管如图所示,用(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸溶液.
②用滴定的方法来测定盐酸的浓度,实验数据如表所示:
实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该未知盐酸的浓度为(保留两位有效数字).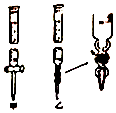
(2)若用酚酞作指示剂,达到滴定终点的标志是 .
(3)造成测定结果偏高的操作可能是 .
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的读数时,滴定前仰视凹液面最低处,滴定后俯视读数.