题目内容
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
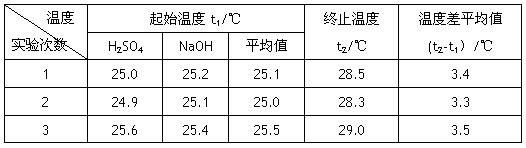
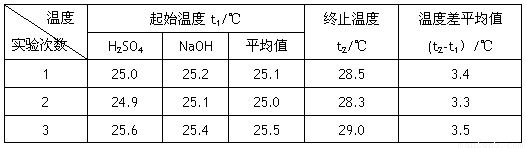
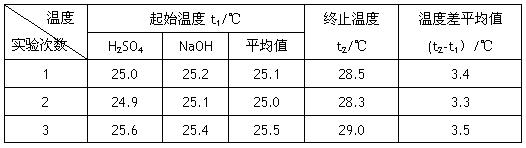
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
25.0 |
25.2 |
25.1 |
28.5 |
3.4 |
|
2 |
24.9 |
25.1 |
25.0 |
28.3 |
3.3 |
|
3 |
25.6 |
25.4 |
25.5 |
29.0 |
3.5 |
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
Ⅰ、(1)确保硫酸被完全中和 (2)B (3)用环形玻璃棒轻轻搅动
(4)56.85 kJ·mol-1 , H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O ΔH=-113.7kJ·mol-1
(5)大于 浓硫酸溶于水放出热量
Ⅱ.答案:(1)CABDE
(2)滴定管要直立,装液后需等min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01 mL
(3)使滴定终点颜色变化更明显,便于分辨 (4)偏高
因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,故烧碱浓度偏高
(5)0.8(V2-V1)M/W×100%

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案