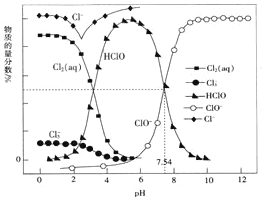
题目内容
【题目】As和P属于同主族元素,它们都能形成多种含氧酸。中国自古就有“信口雌黄”“雄黄入药”之说。雌黄(As2S3)和雄黄(As4S4)早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药。在一定条件下,雌黄和雄黄的转化关系如图所示。

(1)亚磷酸(H3PO3)是一种精细化工产品。亚磷酸(H3PO3)与足量NaOH溶液反应生成Na2HPO3。
①则亚磷酸为___(填“一”“二”或“三”)元酸。
②查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7,Na2HPO3可使碘水褪色,25℃时,Na2HPO3水解反应的Kh=____,若向Na2HPO3溶液中加入少量的I2,则溶液中 将__(填“增大”、“减小”或“不变”)
将__(填“增大”、“减小”或“不变”)
(2)反应II中,若0.5molAs4S4参加反应,转移14 mol电子,则物质a为__(填化学式)
(3)反应Ⅲ中的产物亚砷酸H3AsO3可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。
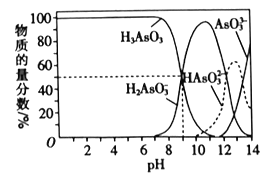
以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为___。
【答案】二 4×10-8 增大 SO2 OH-+H3AsO3=H2AsO3-+H2O
【解析】
(1) ①亚磷酸(H3PO3)与足量NaOH溶液反应生成NaHPO3,说明亚磷酸(H3PO3)只能电离两个氢离子与氢氧化钠反应,故为二元酸;答案:二。
②25℃时,Na2HPO3水解反应为HPO32-+H2O= H2PO3-+OH-,所以水解常数为Kh=c(H2PO3-)c(OH-)/c(HPO32-)= c(H2PO3-)c(OH-)c(H+)/c(HPO32-) c(H+)=KW/ Ka2=10-14/2.5×10-7= 4×10-8。因为Na2HPO3可使碘水褪色,所以若向Na2HPO3溶液中加入少量的I2,c(H2PO3-)减小,HPO32-+H2O= H2PO3-+OH-平衡正向移动,进而促进第二步的水解H2PO3-+H2O= H3PO3+OH-,所以溶液中 将增大;所以答案:4×10-8;增大。
将增大;所以答案:4×10-8;增大。
(2)由题知As4S4与氧气反应生成AS2O3和物质a,0.5molAs4S4参加反应,转移14 mol 电子,其中As元素转移电子数为2mol,故S转移电子数为12mol,故S从-2价变成+4价,故物质a为SO2。答案:SO2。
(3)①根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3浓度增大,说明碱和H3AsO3生成H2AsO3,该反应为酸碱的中和反应,同时还生成水,离子方程式为OH-+H3AsO3=H2AsO3-+H2O
故答案为:OH-+H3AsO3=H2AsO3-+H2O

【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。