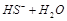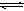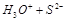题目内容
下列各表述与示意图一致的是
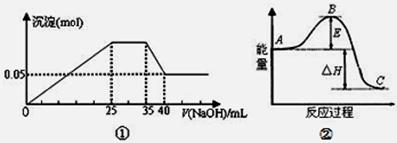

| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2mol/L |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0; |
C
试题分析:A、根据图中各段含义,得到NaOH溶液为25mL到35mL是与NH4+反应,35mL到40mL是与氢氧化铝反应,剩余的为氢氧化镁,故得到n(Mg2+)=0.05mol,根据Al3+与NaOH反应沉淀与溶解时量的关系为3:1确定,与Mg2+反应的NaOH溶液体积为25-5×3=10mL,c(NaOH)=0.05×2÷0.01=10mol/L
根据35mL到40mL段得n(Al3+)=n(NaOH)=0.005×10=0.05mol,
根据25mL到35mL段得n( NH4+)=n(NaOH)=0.01×10=0.1mol
n(Mg2+):n(Al3+):n( NH4+)=0.05mol:0.05mol:0.1mol=1:1:2
本问也可以直接根据25mL到35mL和35mL到40mL两段判断出Al3+、NH4+量的关系,确定答案,错误;B、错误;C、使用催化剂改变反应的活化能,但不能改变反应的焓变,正确;D、物质A反应生成物质C,为放热反应,△H<0,错误。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
 2OH- +Cl2↑ +H2↑
2OH- +Cl2↑ +H2↑