题目内容
18.钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.(1)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),写出铁发生电化学腐蚀时正极的电极反应(中性环境):O2+4e-+2H2O=4OH-.
(2)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的离子方程式2Fe3++Fe═3Fe2+.
(3)图1各个装置中铁棒被腐蚀由难到易的顺序是A.
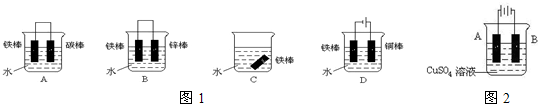
A.D BCA B、ABCD C.DBAC D.BCAD
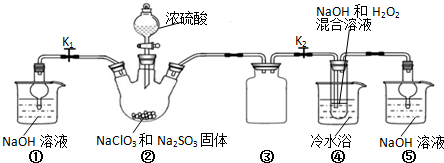
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图2:请回答:
B电极对应的金属是铁(写元素名称),A电极的电极反应式是Cu-2e-=Cu2+.
分析 (1)钢铁在中性环境下发生吸氧腐蚀,正极上氧气放电;
(2)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子;
(3)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
(4)电镀时,镀层作阳极、镀件作阴极,阳极上金属材料失电子发生氧化反应.
解答 解:(1)钢铁在中性环境下发生吸氧腐蚀,正极上氧气放电:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(2)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子,离子方程式为2 Fe3++Fe═3 Fe2+,故答案为:2Fe3++Fe═3 Fe2+;
(3)C装置是铁的正常的腐蚀,A装置中,铁做负极,腐蚀速率加快;B和D装置中,铁均被保护,但由于外加电源的阴极保护法比牺牲阳极的阴极保护法更强有力,故腐蚀由难到易的是:DBCA,故选A;
(4)电镀时,镀层Cu作阳极、镀件Fe作阴极,所以B的材料是Fe,阳极电极反应式为Cu-2e-=Cu2+,故答案为:铁;Cu-2e-=Cu2+.
点评 本题考查金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道金属腐蚀快慢顺序、钢铁发生析氢腐蚀和吸氧腐蚀条件,题目难度不大.

练习册系列答案
相关题目
9.下列说法中正确的是( )
| A. | 硫酸的摩尔质量是98 | |
| B. | 摩尔是阿伏加德罗常数个微粒的集合体 | |
| C. | 6.02Х1023就是阿伏加德罗常数 | |
| D. | 氧气的摩尔质量(单位:g•mol-1)在数值上等于它的相对分子质量 |
3.下列关于金属腐蚀的叙述正确的是( )
| A. | 金属(M表示金属)被腐蚀的本质是:Mn++ne-=M | |
| B. | 金属不可能在碱性环境中发生电化学腐蚀 | |
| C. | 镀锌铁的镀层破损后,镀层仍能对铁起保护作用 | |
| D. | 钢管与外加直流电源的正极相连,以保护它不受腐蚀 |
10.从分类的角度来看,下列说法正确的是( )
| A. | 硅酸、氯化铁均为胶体 | B. | 水玻璃、氯水均为混合物 | ||
| C. | 食醋、纯碱、食盐分别属于酸、碱盐 | D. | 氨气属于非电解质,Cu属于电解质 |
8.下列化学式只表示的一种纯净物的是( )
| A. | CH3Cl | B. | C4H10 | C. | C2H4Cl2 | D. | C |
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
 一无色透明的溶液做如下实验:
一无色透明的溶液做如下实验: