��Ŀ����
����Ŀ����������![]() ��һ�ֹ��ס���Ч����������������ˮ��������ˮ�����ȷ����й㷺Ӧ�ã�������ijУ��ѧ�о�С�����ʵ������ȡ
��һ�ֹ��ס���Ч����������������ˮ��������ˮ�����ȷ����й㷺Ӧ�ã�������ijУ��ѧ�о�С�����ʵ������ȡ![]() �Ĺ�������ͼ�������й�˵����ȷ����
�Ĺ�������ͼ�������й�˵����ȷ����
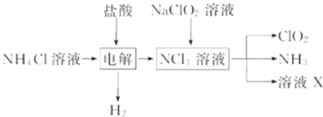
A.���ʱ������Ӧ�Ļ�ѧ����ʽΪ��2HCl![]() Cl2
Cl2![]() +H2
+H2![]()
B.��NaClO2��Һ��ȡ0.6molClO2ʱ����������0.1molNCl3
C.�������Ļ������ͨ��ʢ�м�ʯ�ҵĸ������Գ�ȥClO2�е�NH3
D.��ҺX�ijɷ�ΪNaClO2��NaOH
���𰸡�B
��������
A.��������ͼ֪,����Ȼ�狀���������Һ����������NCl3����Ӧ�Ļ�ѧ����ʽΪ��![]()
![]()
![]() ����A����
����A����
B. NCl3��NaClO2�����ʵ���֮��Ϊ1��6ǡ�÷�Ӧ����ClO2���Ȼ��ơ����������Ͱ�������Ӧ��ClԪ�صĻ��ϼ����߱���������NԪ�ػ��ϼ۽��ͱ���ԭ����ѧ����ʽΪ��![]() ���ɷ���ʽ��֪NaClO2��Һ��ȡ 0.6molClO2ʱ����������0.1molNCl3����B��ȷ��
���ɷ���ʽ��֪NaClO2��Һ��ȡ 0.6molClO2ʱ����������0.1molNCl3����B��ȷ��
C.����Ϊ�������壬��ʯ�Ҳ������հ�����Ӧ����Ũ�������հ�������C����
D.��ϵ����غ���������֪��NCl3��NaClO2�����ʵ���֮��Ϊ1��6ǡ�÷�Ӧ����ClO2���������Ȼ��ƺ�NaOH����D����
��ѡB��

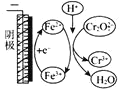
����Ŀ������п����������п������ӡȾýȾ��������п��(��Ҫ�ɷ�ΪZnO��������Fe2O3��CuO��SiO2���ӳ�) �Ʊ�ZnSO4 ��7H2O������������
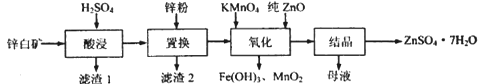
�����������������������������pH (��ʼ������pH����������Ũ��Ϊ1.0mol��L-1���㣩���±���
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)������1������Ҫ�ɷ�Ϊ_________(�ѧʽ����������������У����пԪ�ؽ����ʵĴ�ʩ�����ʵ�������Ũ�ȡ�______________(��һ��)��
(2)���û��������У�����������п�ۣ�������Һ�е�Fe3+��H+��Ӧ�⣬��һ��Ҫ��Ӧ����ѧ����ʽΪ__________________________��
(3)��������һ���У�������Ӧ�����ӷ���ʽΪ_______________________����ҺpH������[3.2��6.4)֮����Ŀ����________________��
(4)��ĸҺ���к��е�����������_________ (�ѧʽ����
����Ŀ��H��Al��O��N��S��Fe�dz���������Ԫ�ء�
��1��Sλ��Ԫ�����ڱ�______���ڵ�______�壬Fe�Ļ�̬ԭ�Ӻ���۵����Ų�ʽΪ______��O�Ļ�̬ԭ�Ӻ�����______���˶�״̬��ͬ�ĵ��ӡ�
��2���������������=�����
��һ������ | ������ | �е� | �ǽ����� |
N______S | Fe3+______ Al3+ | NH3______H2O | 16O______18O |
��3����֪�����������Ȼ�ѧ����ʽ��
4Fe��s��+302��g��=2Fe2O3��s����H=��a kJ/mol
4Al��s��+3O2��g��=2Al2O3��s����H=��b kJ/mol
��Al��s���ĵ��ʺ�Fe2O3��s����Ӧ���Ȼ�ѧ����ʽ��______��
��4��FeSO4��Һ�������ᷢ����Ӧ��д���˷�Ӧ�����ӷ���ʽ�����������ת�Ƶķ������Ŀ____________________________��
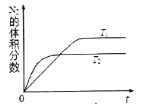
����Ŀ���õ�ⷨ������![]() �ķ�ˮ��̽����ͬ���ضԺ�
�ķ�ˮ��̽����ͬ���ضԺ�![]() ��ˮ������Ӱ�죬��������ʾ
��ˮ������Ӱ�죬��������ʾ![]() ����ʼŨ�ȡ��������ѹ�����ʱ�����ͬ
����ʼŨ�ȡ��������ѹ�����ʱ�����ͬ![]() ������˵���������
������˵��������� ![]()
![]()
ʵ�� |
|
|
|
|
|
�Ƿ���� | �� | �� | ����30g | �� | |
�Ƿ����H2SO4 | �� | ����1mL | ����1mL | ����1mL | |
�������� | ʯī | ʯī | ʯī | ʯī | |
�������� | ʯī | ʯī | ʯī | �� | |
| 0.092% | 12.7% | 20.8% | 57.3% | ʵ�� |
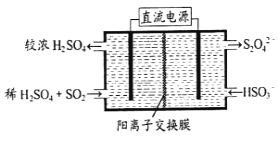
A.ʵ��![]() ��ʵ��
��ʵ��![]() �Աȣ������������䣬����
�Աȣ������������䣬����![]() ������
������![]() ��ȥ��
��ȥ��
B.ʵ��![]() ��ʵ��
��ʵ��![]() �Աȣ������������䣬����
�Աȣ������������䣬����![]() ������
������![]() ��ȥ��
��ȥ��
C.ʵ��![]() ��
��![]() ѭ�����������
ѭ�����������![]() ��ȥ����
��ȥ����
D.��ʵ��![]() ��ȥ��
��ȥ��![]() ����·�й�ת��0.06mol����
����·�й�ת��0.06mol����