题目内容
(10分)某同学为研究氧化铁与过量炭粉的反应,进行如下实验:
①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按如图装置连接。
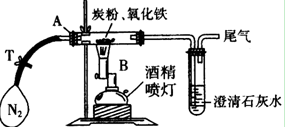
②通一段时间纯净、干燥的氮气。
③夹紧T处弹簧夹,然后点燃酒精灯,加热一段时间后,澄清石灰水变浑浊。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g。
⑴实验步骤①加入药品前,先进行的操作是 。
⑵实验步骤②通入N2的目的是 ,实验室可以用氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_____________________________________________________________。
⑶经计算,参加反应的碳元素质量为 g。
⑷反应生成的气体是______________________,
该实验的化学方程式为:__________________________________________________。
⑸该实验设计存在不合理之处,请指出并说明改进方法 _________
_______________________________________________________________________。
①称取3.2 g氧化铁与2 g炭粉均匀混合,放入48.48 g的玻璃管中,按如图装置连接。

②通一段时间纯净、干燥的氮气。
③夹紧T处弹簧夹,然后点燃酒精灯,加热一段时间后,澄清石灰水变浑浊。
④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g。
⑴实验步骤①加入药品前,先进行的操作是 。
⑵实验步骤②通入N2的目的是 ,实验室可以用氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_____________________________________________________________。
⑶经计算,参加反应的碳元素质量为 g。
⑷反应生成的气体是______________________,
该实验的化学方程式为:__________________________________________________。
⑸该实验设计存在不合理之处,请指出并说明改进方法 _________
_______________________________________________________________________。
⑴检验装置的气密性
⑵将装置中的氧气(空气)排尽 NH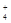 +NO
+NO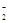
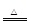 N2↑+2H2O
N2↑+2H2O
⑶经计算,参加反应的碳元素质量为0.48g。
⑷反应生成的气体是CO和CO2 2C+Fe2O3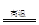 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
⑸未考虑尾气可能有CO,气体排放会污染大气,点燃尾气。
⑵将装置中的氧气(空气)排尽 NH
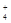 +NO
+NO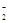
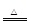 N2↑+2H2O
N2↑+2H2O⑶经计算,参加反应的碳元素质量为0.48g。
⑷反应生成的气体是CO和CO2 2C+Fe2O3
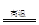 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑⑸未考虑尾气可能有CO,气体排放会污染大气,点燃尾气。
(1)实验涉及有仪器组合和连接,在连接好仪器,首先应进行的操作是检验装置的气密性。(2)在加热得情况下炭粉会和氧气反应,同时空气的存在也会影响反应进程。(3)氯化铵饱和溶液和亚硝酸钠饱和溶液混合加热反应制得氮气的离子反应方程式是NH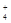 +NO
+NO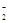
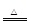 N2↑+2H2O。(3)过量的炭粉和氧化铁反应可知生成的气体物质应该为CO和CO2的混合物,反应物氧化铁的物质的量为3.2g÷160g/mol=0.02mol,其中所含的氧元素的物质的量为0.06mol。设生成的CO的物质的量为x mol,生成的CO2的物质的量为y mol。可得28x+44y=48.48+3.2+2-52.24,x+2y=0.06,解得x=y=0.02。所以参加反应的碳元素的物质的量为0.04mol,则其质量为0.48g。(4)由于反应中炭粉过量,那么生成的气体应该既有CO2又有CO,该反应的化学方程式为2C+Fe2O3
N2↑+2H2O。(3)过量的炭粉和氧化铁反应可知生成的气体物质应该为CO和CO2的混合物,反应物氧化铁的物质的量为3.2g÷160g/mol=0.02mol,其中所含的氧元素的物质的量为0.06mol。设生成的CO的物质的量为x mol,生成的CO2的物质的量为y mol。可得28x+44y=48.48+3.2+2-52.24,x+2y=0.06,解得x=y=0.02。所以参加反应的碳元素的物质的量为0.04mol,则其质量为0.48g。(4)由于反应中炭粉过量,那么生成的气体应该既有CO2又有CO,该反应的化学方程式为2C+Fe2O3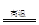 2Fe+CO↑+CO2↑。(5)未考虑尾气可能含有CO,直接排放会污染大气,所以可以用点燃的方法做尾气处理。
2Fe+CO↑+CO2↑。(5)未考虑尾气可能含有CO,直接排放会污染大气,所以可以用点燃的方法做尾气处理。
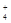 +NO
+NO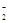
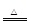 N2↑+2H2O。(3)过量的炭粉和氧化铁反应可知生成的气体物质应该为CO和CO2的混合物,反应物氧化铁的物质的量为3.2g÷160g/mol=0.02mol,其中所含的氧元素的物质的量为0.06mol。设生成的CO的物质的量为x mol,生成的CO2的物质的量为y mol。可得28x+44y=48.48+3.2+2-52.24,x+2y=0.06,解得x=y=0.02。所以参加反应的碳元素的物质的量为0.04mol,则其质量为0.48g。(4)由于反应中炭粉过量,那么生成的气体应该既有CO2又有CO,该反应的化学方程式为2C+Fe2O3
N2↑+2H2O。(3)过量的炭粉和氧化铁反应可知生成的气体物质应该为CO和CO2的混合物,反应物氧化铁的物质的量为3.2g÷160g/mol=0.02mol,其中所含的氧元素的物质的量为0.06mol。设生成的CO的物质的量为x mol,生成的CO2的物质的量为y mol。可得28x+44y=48.48+3.2+2-52.24,x+2y=0.06,解得x=y=0.02。所以参加反应的碳元素的物质的量为0.04mol,则其质量为0.48g。(4)由于反应中炭粉过量,那么生成的气体应该既有CO2又有CO,该反应的化学方程式为2C+Fe2O3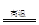 2Fe+CO↑+CO2↑。(5)未考虑尾气可能含有CO,直接排放会污染大气,所以可以用点燃的方法做尾气处理。
2Fe+CO↑+CO2↑。(5)未考虑尾气可能含有CO,直接排放会污染大气,所以可以用点燃的方法做尾气处理。
练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
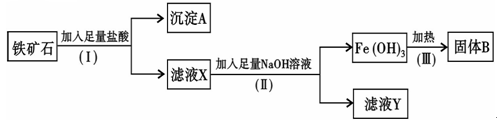
 (填化学式),固体B是 (填化学式);
(填化学式),固体B是 (填化学式);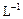 盐酸中,得溶液C;
盐酸中,得溶液C;