题目内容
某学习小组设计用如图装置验证二氧化硫的化学性质。
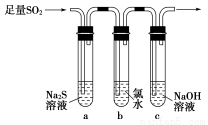
(1)能说明二氧化硫具有氧化性的实验现象为_________________________。
(2)为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
(3)当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(1)试管a中出现淡黄色浑浊
(2)Ⅲ SO2+Cl2+2H2O=4H++SO42-+2Cl-
(3)2c(SO32-)+c(HSO3-)
【解析】(1)SO2能将S2-氧化,生成硫单质。(2)方案Ⅰ,氯水中加入AgNO3溶液也可得到白色沉淀;方案Ⅱ中二氧化硫和氯水均可使品红褪色;方案Ⅲ中产生沉淀可证明SO2与Cl2发生了氧化还原反应(因溶液显酸性,不会产生BaSO3沉淀,而是BaSO4沉淀)。(3)溶液中存在电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),溶液显中性,则c(H+)=c(OH-),故c(Na+)=2c(SO32-)+c(HSO3-)。

练习册系列答案
相关题目