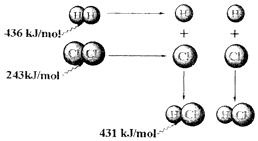
��Ŀ����
����Ŀ��H1N1������һ��û�г����ֿ����IJ������о�֤�������ೣ������ҩ����Ư�۾���Ư�ۡ�������صȣ����Խ�H1N1����ɱ��
��1����ҵ����ȡƯ�۵ķ�Ӧ����ʽΪ ��
��2����Ư����������ˮ�У��ʰ�ɫ��״����ó�����ȡ�����ϲ���Һ���μ�̼������Һ���ְ�ɫ������д������һ����ѧ����ʽ �� ��ȡ�����ϲ���Һ���μ����������ѧʽ�����ɼ���Cl���Ĵ��ڣ�������Ӧ�Ļ�ѧ����ʽΪ ��
��3��Ư���ڿ����г��ڷ��ã���ʧЧ���û�ѧ����ʽ������ԭ�� ��
���𰸡�
��1��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O
��2��CaCl2+Na2CO3�TCaCO3��+2NaCl��AgNO3��HNO3��CaCl2+2AgNO3�T2AgCl��+Ca��NO3��2
��3��Ca��ClO��2+H2O+CO2=CaCO3+2HClO��2HClO ![]() 2HCl+O2��
2HCl+O2��
���������⣺��1���������������Ʒ�Ӧ�Ʊ�Ư�ۣ���Ư�۵���Ҫ�ɷ�ΪCa��ClO��2��CaCl2 �� ��Ч�ɷ�ΪCa��ClO��2 �� ��ҵ����ȡƯ�۵Ļ�ѧ����ʽΪ��2Cl2+2Ca��OH��2�TCa��ClO��2+CaCl2+2H2O�����Դ��ǣ�2Cl2+2Ca��OH��2�TCa��ClO��2+CaCl2+2H2O����2����Ư����������ˮ�У��ʰ�ɫ��״����ó�����ȡ�����ϲ���Һ���μ�̼������Һ��̼���Ƶ������̼������Ӻ���Һ�еĸ����ӷ�����Ӧ��CaCl2+Na2CO3�TCaCO3��+2NaCl�����ְ�ɫ̼��Ƴ���������Ư���е������ӣ�Ӧ�ȼ�HNO3�ữ���ٵμ�AgNO3��Һ������CaCl2+2AgNO3�T2AgCl��+Ca��NO3��2 �� �۲쵽��ɫ��������˵��Cl�����ڣ����Դ��ǣ�CaCl2+Na2CO3�TCaCO3��+2NaCl��AgNO3��HNO3��CaCl2+2AgNO3�T2AgCl��+Ca��NO3��2����3��Ư���ڿ����г��ڷ���ʧЧ����ΪƯ���ܹ�������еĶ�����̼��Ӧ���ɴ����ᣬ��������в��ȶ��ԣ������ֽ⣬��ѧ����ʽ��Ca��ClO��2+CO2+H2O=CaCO3��+2HClO��2HClO ![]() 2HCl+O2�������Դ��ǣ�Ca��ClO��2+CO2+H2O=CaCO3��+2HClO��2HClO
2HCl+O2�������Դ��ǣ�Ca��ClO��2+CO2+H2O=CaCO3��+2HClO��2HClO ![]() 2HCl+O2����
2HCl+O2����

����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£� 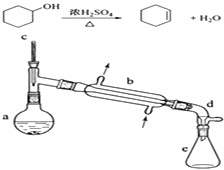
�����õ����й��������£�
��Է������� | �ܶȣ�g/cm3�� | �е�/�� | �ܽ��� | |
������ | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
�ϳɷ�Ӧ��
��a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᣮb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�森
�����ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10g��
�ش��������⣺
��1��װ��a�������� ��
��2���������Ƭ�����������������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������������ȷ�𰸱�ţ���
A���������� B����ȴ�� C�����貹�� D����������
��3����Һ©����ʹ��ǰ����ϴ�ɾ������ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©��������Ͽڵ��������¿ڷų�������
��4�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ���� ��
��5���ڻ���ϩ�ֲ�����������У������õ�����������ABE��������ȷ�𰸱�ţ���
AԲ����ƿ B�¶ȼ� C©�� D������ E������
��6����ʵ�����õ��Ļ���ϩ������ �� ��������λ��Ч���֣�
��ע������= ![]() ��100%��
��100%��
����Ŀ���������й�ij�ֵ���ø��ʵ�飬������ʽ����������ͼ��ʾ�����ݽ���жϣ�������ȷ���� �� ��
�Թܱ�� | �Թܢ� | �Թܢ� | �Թܢ� |
pH | 8 | 8 | 7 |
�¶� | 60�� | 40�� | 40�� |
����ø | 1mL | 1mL | 1mL |
���� | 1mL | 1mL | 1mL |

A���������ǵ���ø���Ƽ�
B�����ֵ���ø������35min����ʧȥ����
C�����ֵ���ø�����Ի����е��������ʱ��ڼ����еĿ�
D�����ֵ���ø���ʺ���40��Ļ�����������