题目内容
将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如下图。(横坐标体积单位是mL,纵坐标质量单位是g)求: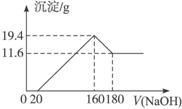
(1)合金中Mg的质量。
(2)所用HCl的物质的量浓度。
解析:(1)由图象可知
答案:(1)

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: 某研究小组将一定质量的镁铝合金材料投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的变化如图所示.
某研究小组将一定质量的镁铝合金材料投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的变化如图所示. 将一定质量的镁铝合金投入100ml一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.求:
将一定质量的镁铝合金投入100ml一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.求: 将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.由图中数据计算:
将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示.由图中数据计算: