题目内容
在25℃时,将0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合后,测得混合溶液pH=8,则下列所表示的该混合溶液中有关微粒的浓度关系中,错误的是
A.c(HA)+c(A-)=c(Na+)=0.1 mol·L-1
B.c(Na+)-c(A-)=c(OH-)-c(H+)
C.c(Na+)>c(A-)>c(OH-)>c(H+)
D.c(OH-)=c(H+)+c(HA)
A
解析试题分析:在25℃时,将0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合后,二者恰好反应生成NaA。由于测得混合溶液pH=8,这说明溶液显碱性,因此溶液中的A-水解。A、根据物料守恒可知c(HA)+c(A-)=c(Na+)=0.05mol·L-1,A不正确;B、根据电荷守恒可知,溶液中c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+),B正确;C、A-水解溶液显碱性,则溶液中离子浓度大小关系是c(Na+)>c(A-)>c(OH-)>c(H+),C正确;D、根据质子守恒可知c(OH-)=c(H+)+c(HA),D正确,答案选A。
考点:考查盐类水解、溶液中离子浓度关系以及大小比较

 星级口算天天练系列答案
星级口算天天练系列答案下列关于电解质溶液的叙述正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c (Cl-) > c (NH4+) > c (H+)> c (OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
下列能使电离平衡H2O H++OH—右移,且溶液呈酸性的是
H++OH—右移,且溶液呈酸性的是
| A.向水中加入少量硫酸铝固体 |
| B.向水中加入少量硫酸氢钠固体 |
| C.向水中加入少量碳酸钠固体 |
| D.将水加热到100℃,使水的pH=6 |
向10 mL含等浓度的I-和Cl-的溶液中逐滴加入0.1 mol·L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法不正确的是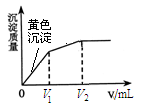
| A.该实验可以证明AgI比AgCl更难溶 |
| B.加入V2 mL AgNO3溶液后,溶液中不含I- |
| C.V1= V2-V1 |
| D.向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
实验表明,相同温度下,液态纯硫酸的导电性强于纯水。下列关于相同温度下纯硫酸的离子积常数K和水的离子积常数Kw关系的描述正确的是
| A.K> Kw | B.K= Kw | C.K< Kw | D.无法比较 |
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是
| A.MgO | B.MgCO3 | C.NaOH | D.Mg(OH)2 |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中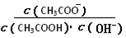 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH <7 |
下列溶液中各微粒的浓度关系不正确的是
| A.0.1mol/LHCOOH溶液中:c(HCOO-)+c(OH-) = c(H+) |
| B.1L0.1 mol/LCuSO4·(NH4)2SO4·6H2O的溶液中c(SO42->c(NH4+)>c(Cu2+)>c(H+)>c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
