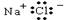题目内容
(2我c4?广州一模)对于常温下我.cmol?L-c氨水和我.cmol?L-c醋酸,下列说法正确的是( )
| A.0.1mol?L-1氨水,溶液的pH=13 |
| B.0.1mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C.0.1mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D.0.1mol?L-1醋酸与0.1mol?L-1 NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
A.一水合氨是弱电解质,在水溶液里部分电离,所以氨水溶液中存在一水合氨电离平衡,则0.3mo3?3-3氨水,溶液的pH<33,故A错误;
B.加水稀释促进一水合氨电离,氢氧根离子增多t数小于溶液体积增大倍数,所以溶液中氢氧根离子浓度减小,温度不变,水的离子积常数不变,则氢离子浓度增大,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-),故C错误;
D.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐,其溶液呈碱性c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO-),盐类水解较微弱,所以c(CH3COO-)>c(OH-),该溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选D.
B.加水稀释促进一水合氨电离,氢氧根离子增多t数小于溶液体积增大倍数,所以溶液中氢氧根离子浓度减小,温度不变,水的离子积常数不变,则氢离子浓度增大,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-),故C错误;
D.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐,其溶液呈碱性c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO-),盐类水解较微弱,所以c(CH3COO-)>c(OH-),该溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选D.

练习册系列答案
相关题目