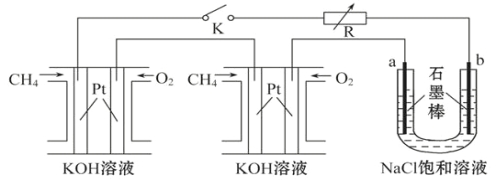
题目内容
【题目】在2L容积不变的密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:

(1)用O2的反应速率表示0~2s内该反应的平均反应速率v=_______________。若上述反应在850℃下进行,反应2s时n(NO)=0.009mol,并且不再随时间而改变,则该反应是__________热反应。
(2)图中表示NO2浓度变化的曲线是__________(填字母)。
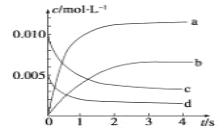
(3)能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内的压强保持不变
C.v逆(NO)=2v正(O2) D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________(填序号)。
A.及时分离出NO2 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
【答案】(1)0.0015mol·L-1·s-1;(2分) 放;(2分)
(2)b;(2分) (3)BC;(2分) (4)C (2分)
【解析】
试题分析:(1)2s内用NO表示的平均反应速率v(NO)=[△n(NO)÷V ]÷t=(0.020mol0.008mol)÷2L÷2s=3.0×10-3 mol/(Ls),速率之比等于化学计量数之比,所以v(O2)=1/2 v(NO)=1.5×10-3 mol/(Ls);若上述反应在850℃下进行,反应2s时n(NO)=0.009mol,这说明升高温度,化学平衡向逆反应方向移动。根据化学平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应是吸热反应,则该反应的正反应是放热反应;
(2)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=(0.020mol 0.007mol)÷2L=0.0065mol/L,根据方程式中NO与NO2的系数关系可知,图中表示NO2变化的曲线是b;
(3)A.表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,A错误;B.随反应进行,反应混合气体总的物质的量在减小,容器内的压强减小,当压强保持不变,说明反应到达平衡,B正确;C.不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆(NO):V正(O2)=2:1,即V逆(NO)=2 V正(O2),C正确;D.混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,D错误,答案选BC;
(4)2NO(g)+O2(g)![]() 2NO2(g)正方向为体积减小的放热反应,A.减小生成物的浓度平衡正向移动,及时分离除NO2气体,平衡正移,但是浓度减小,速率减小,A错误;B.适当升高温度,化学平衡向吸热的逆反应方向移动,B错误;C.增大O2的浓度,平衡正向移动,反应物浓度增大,速率加快,C正确;D.选择高效催化剂,反应速率加快,但是平衡不移动,D错误。答案选C。
2NO2(g)正方向为体积减小的放热反应,A.减小生成物的浓度平衡正向移动,及时分离除NO2气体,平衡正移,但是浓度减小,速率减小,A错误;B.适当升高温度,化学平衡向吸热的逆反应方向移动,B错误;C.增大O2的浓度,平衡正向移动,反应物浓度增大,速率加快,C正确;D.选择高效催化剂,反应速率加快,但是平衡不移动,D错误。答案选C。

【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D