题目内容
下列说法正确的是
- A.同温同压下,同体积的氧气与空气所含原子数相等
- B.在标准状况下,1mol任何气体所含分子数都约为6.02×1023
- C.当温度高于0℃,1mol任何气体的体积都大于22.4L
- D.当压强大于101kPa时,1mol任何气体的体积都小于22.4L
B
分析:A、同温同压下,同体积的氧气与空气含有相同的分子数,氧气是双原子分子,可以为混合物,各组分不都是双原子分子.
B、结合N=nNA计算分子数,NA=6.02×1023mol-1.
C、物质的量相同时,影响气体体积的元素有温度、压强,温度与体积成正比.
D、物质的量相同时,影响气体体积的元素有温度、压强,压强与体积成反比.
解答:A、同温同压下,同体积的氧气与空气含有相同的分子数,氧气是双原子分子,空气为混合物,各组分不都是双原子分子,故原子数目不相同,故A错误;
B、标准状况下,1mol任何气体的分子数为1mol×6.02×1023mol-1=6.02×1023,故B正确;
C、若为1个大气压,温度高于0℃,气体摩尔体积大于22.4L/mol,1mol任何气体的体积都大于22.4L.物质的量相同时,影响气体体积的元素有温度、压强,气体压强不一定,无法判断体积,故C错误;
D、若为0℃,当压强大于101kPa时,1mol任何气体的体积都小于22.4L,物质的量相同时,影响气体体积的元素有温度、压强,气体温度不一定,无法判断体积,故D错误.
故选:B.
点评:考查学生对阿伏伽德罗定律及推论的理解与运用,难度不大,注意基础知识的理解掌握,可借助PV=nRT理解阿伏伽德罗定律及推论.
分析:A、同温同压下,同体积的氧气与空气含有相同的分子数,氧气是双原子分子,可以为混合物,各组分不都是双原子分子.
B、结合N=nNA计算分子数,NA=6.02×1023mol-1.
C、物质的量相同时,影响气体体积的元素有温度、压强,温度与体积成正比.
D、物质的量相同时,影响气体体积的元素有温度、压强,压强与体积成反比.
解答:A、同温同压下,同体积的氧气与空气含有相同的分子数,氧气是双原子分子,空气为混合物,各组分不都是双原子分子,故原子数目不相同,故A错误;
B、标准状况下,1mol任何气体的分子数为1mol×6.02×1023mol-1=6.02×1023,故B正确;
C、若为1个大气压,温度高于0℃,气体摩尔体积大于22.4L/mol,1mol任何气体的体积都大于22.4L.物质的量相同时,影响气体体积的元素有温度、压强,气体压强不一定,无法判断体积,故C错误;
D、若为0℃,当压强大于101kPa时,1mol任何气体的体积都小于22.4L,物质的量相同时,影响气体体积的元素有温度、压强,气体温度不一定,无法判断体积,故D错误.
故选:B.
点评:考查学生对阿伏伽德罗定律及推论的理解与运用,难度不大,注意基础知识的理解掌握,可借助PV=nRT理解阿伏伽德罗定律及推论.

练习册系列答案
相关题目
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题.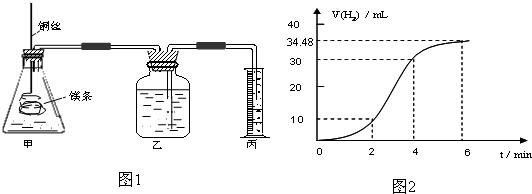
(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是 .(填代号)
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为 .(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
①上表中V1= mL,V3= mL.
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是 .
③若实验测得t2>t3>t4,则可得出的实验结论是 .

(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是
③若实验测得t2>t3>t4,则可得出的实验结论是


 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.