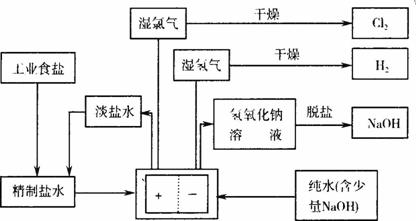
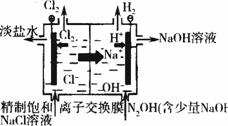
题目内容
在隔膜法电解食盐水过程中,与电源正极相联的电极上所发生反应为________________________,与电源负极相连的电极附近溶液的pH________(填“升高”、“下降”或“不变”).离子交换膜的作用是______________________,若采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为___________________.
解析:
(第二空1分,其余每空2分,共7分)
2Cl--2e-=Cl2↑ 升高
阻止气体分子和某些离子通过,防止氢气和氯气混合发生爆炸,并能避免氯气和氢氧化钠溶液作用生成次氯酸钠而影响烧碱的质量
NaCl+H2O![]() NaClO+H2↑ 或2NaCl+2H2O
NaClO+H2↑ 或2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
Cl2+2NaOH![]() NaCl+NaClO+H2O
NaCl+NaClO+H2O

氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产????????? ??? 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是??? (填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡??? b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡??? d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。

回答下列问题:
①酸洗过程中加入的酸为??? ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 ?????????????????? 。
②过滤所得滤渣的主要成分为 ?????????????????? ? 。
③根据图分析,蒸发结晶过滤所得晶体A主要成分为 ?????????? ?? 。

④真空干燥MgSO4·7H2O晶体的原因是??????????????? ??? 。