题目内容
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液.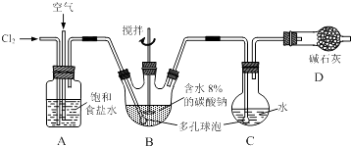
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2 .
(1)①实验中控制氯气与空气体积比的方法是 .
②为使反应充分进行,实验中采取的措施有 .
(2)①装置B中产生Cl2O的化学方程式为: .
②若B无冷却装置,则进入C中的Cl2O会大量减少.其原因是 .
(3)装置C中采用棕色圆底烧瓶是因为 .
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl﹣ . 测定C中次氯酸溶液的物质的量浓度的实验方案为:用取20.00mL次氯酸溶液, . (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液.除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
【答案】
(1)通过观察A中产生气泡的速率调节流速;搅拌、使用多孔球泡
(2)2Cl2+Na2CO3=Cl2O+2NaCl+CO2;该反应放热,温度升高Cl2O会分解
(3)HClO见光易分解
(4)酸式滴定管;加入足量的H2O2溶液,再加入足量的硝酸银溶液,过滤,洗涤,在真空干燥箱中干燥,用电子天平称量沉淀质量
【解析】解:(1)①氯气和空气按照体积比约1:3混合通入潮湿碳酸钠中,控制氯气与空气体积比的方法可以通过观察A中产生气泡的比例来调节气体的流速,
所以答案是:通过观察A中产生气泡的速率调节流速;
②为了氯气和原溶液充分接触完全反应,可以通过增加气体与溶液的接触面积、并用搅拌棒搅拌等方法,
所以答案是:搅拌、使用多孔球泡;(2)①装置B中,氯气本身既作为氧化剂又作还原剂,本身被氧化到+1价的Cl2O,被还原到﹣1价的氯化钠,故化学方程式为2Cl2+Na2CO3═Cl2O+2NaCl+CO2 ,
所以答案是:2Cl2+Na2CO3═Cl2O+2NaCl+CO2;(4)由于该反应为放热反应,温度升高Cl2O会分解,故进入C中的Cl2O会大量减少,
所以答案是:该反应放热,温度升高Cl2O会分解;(3)装置C中使用棕色平底烧瓶,目的是可以避光,防止反应生成的HClO见光分解,
所以答案是:HClO见光易分解;(4)选择使用酸式滴定管量取20.00mL的次氯酸溶液,具体实验操作是,向20.00mL的次氯酸溶液里加入足量的H2O2溶液,再加入足量的硝酸银溶液,过滤、洗涤,在真空干燥箱中干燥沉淀,用电子天平称量沉淀的质量,
所以答案是:酸式滴定管; 加入足量的H2O2溶液,再加入足量的硝酸银溶液,过滤,洗涤,在真空干燥箱中干燥,用电子天平称量沉淀质量.