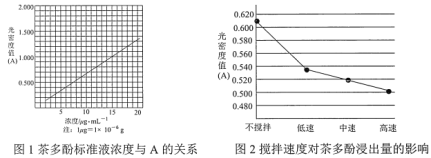
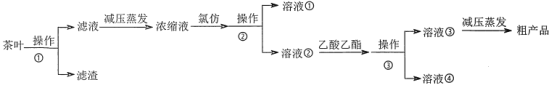
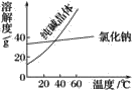
题目内容
【题目】为探究不含结晶水的白色正盐X(仅含三种元素)的组成和性质,设计并完成如下实验:

已知:M(X)=270g·mol-1,灼烧X并透过蓝色钴玻璃片可看到紫色火焰。请回答:
(1)无色液体B的化学式是____。
(2)固体X加热分解的化学方程式是____。
(3)将X加入MnSO4溶液中,溶液变成紫红色,该反应的离子方程式为____。
【答案】SO3 2K2S2O8![]() 2K2SO4+2SO3↑+O2↑ 2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+
2K2SO4+2SO3↑+O2↑ 2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+
【解析】
不含结晶水的白色正盐X(仅含三种元素)5.40g,加热分解生成混合气体A和无色固体A,无色固体A加入盐酸和足量氯化钡溶液生成白色沉淀C为BaSO4,物质的量=![]() =0.02mol,说明A中含硫酸根离子,混合气体A冷却至室温得到气体B和无色液体B,加入盐酸和足量氯化钡溶液得到白色沉淀D为BaSO4,物质的量=
=0.02mol,说明A中含硫酸根离子,混合气体A冷却至室温得到气体B和无色液体B,加入盐酸和足量氯化钡溶液得到白色沉淀D为BaSO4,物质的量=![]() =0.02mol,说明无色液体B为SO3,气体B通过灼热氧化铜网,铜网变黑色增重0.32g,说明气体B为O2,增重的是生成氧气的质量,氧气物质的量=
=0.02mol,说明无色液体B为SO3,气体B通过灼热氧化铜网,铜网变黑色增重0.32g,说明气体B为O2,增重的是生成氧气的质量,氧气物质的量=![]() =0.01mol,混合气体A为SO3和O2的混合气体,已知:M(X)=270gmol-1,灼烧X并透过蓝色钴玻璃片可看到紫色火焰,证明X中含钾元素,利用元素守恒计算得到X的化学式,含n(S)=0.04mol,无色固体A为K2SO4,n(K)=0.04mol,混合气体A为SO3和O2的混合气体,则X中含氧元素物质的量n(O)=
=0.01mol,混合气体A为SO3和O2的混合气体,已知:M(X)=270gmol-1,灼烧X并透过蓝色钴玻璃片可看到紫色火焰,证明X中含钾元素,利用元素守恒计算得到X的化学式,含n(S)=0.04mol,无色固体A为K2SO4,n(K)=0.04mol,混合气体A为SO3和O2的混合气体,则X中含氧元素物质的量n(O)=![]() =0.16mol,n(K):n(S):(O)=0.04:0.04:0.16=1:1:4,结合元素物质的量和原子守恒得到反应生成物为2K2SO4+2SO3+O2,原子守恒得到反应物2K2S2O8,分解的化学方程式:2K2S2O8
=0.16mol,n(K):n(S):(O)=0.04:0.04:0.16=1:1:4,结合元素物质的量和原子守恒得到反应生成物为2K2SO4+2SO3+O2,原子守恒得到反应物2K2S2O8,分解的化学方程式:2K2S2O8![]() 2K2SO4+2SO3↑+O2↑,据此分析回答问题。
2K2SO4+2SO3↑+O2↑,据此分析回答问题。
(1)分析可知无色液体B的化学式是SO3;
(2)固体X加热分解的化学方程式是:2K2S2O8![]() 2K2SO4+2SO3↑+O2↑;
2K2SO4+2SO3↑+O2↑;
(3)将X加入MnSO4溶液中,溶液变成紫红色,说明锰离子被氧化为高锰酸钾,反应的离子方程式:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+。