题目内容
【题目】(1)氮和碳的化合物与人类生产、生活密切相关。已知:
N2(g)+O2(g)===2NO(g);ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH= 。
(2)在压强为0.1 MPa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g);ΔH<0。
CH3OH(g);ΔH<0。
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增大甲醇产率的是 (填字母)。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
(3)如图所示的装置能吸收和转化NO2和SO2。
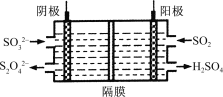
阳极区的电极反应式为 。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式: 。
可在阴极区再生。写出该反应的离子方程式: 。
(4)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
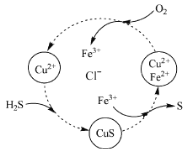
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
【答案】
(1)-664.1kJ·mol-1(2)①c(CH3OH)/c(CO)·c2(H2)②B
(3)①SO2-2e-+2H2O===SO![]() +4H+②4S2O
+4H+②4S2O![]() +2NO2+8OH-=8SO
+2NO2+8OH-=8SO![]() +N2+4H2O
+N2+4H2O
(4)①铜、氢、氯②0.5mol
【解析】
试题分析:(1)①已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ·mol-1,
依据盖斯定律可知②-①得:2H2(g)+2NO(g)=N2(g)+2H2O(l),
△H=(-483.6 kJ/mol)-180.5kJ/mol═-664.1 kJ/mol;
(2)①CO(g)+2H2(g)CH3OH(g)△H<0,反应的平衡常数为:K=![]() ;
;
②A.升高温度,平衡逆向进行,甲醇产率减小,故A错误;B.将CH3OH(g)从体系中分离,平衡正向进行,甲醇产率增大,故B正确;C.充入He,使体系总压强增大,分压不变,平衡不动,故C错误;故答案为B;
(3)①依据图示可知,二氧化硫在阳极区域被氧化为硫酸根,即阳极区发生反应SO2-2e-+2H2O═SO42-+4H+;②阴极排出的S2O![]() 离子,能将NO2气体转化为无污染气体,此气体为N2,同时生成SO
离子,能将NO2气体转化为无污染气体,此气体为N2,同时生成SO![]() ,根据电子守恒、电荷守恒及原子守恒可知该反应的离子方程式为4S2O
,根据电子守恒、电荷守恒及原子守恒可知该反应的离子方程式为4S2O![]() +2 NO2+8OH-=8SO
+2 NO2+8OH-=8SO![]() +N2+4H2O;
+N2+4H2O;
(4)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素;②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,根据氧化还原反应中得失电子相等得,反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,消耗O2的物质的量=![]() =0.5mol。
=0.5mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案