题目内容
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为:2MnO4- +16H+ + 5Na2O2 ="===" 2Mn2+ +5O2↑ + 8H2O + 10Na+ 下列判断正确的是( )
| A.高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂 |
| B.反应的氧化产物只有氧气 |
| C.当反应产生标准状况下2.24L O2时,反应转移的电子为0.2mol |
| D.向高锰酸钾溶液滴加浓盐酸可以得到酸性高锰酸钾溶液 |
BC
考查氧化还原反应
由所给化学反应方程式可看出,锰元素由+7价降至+2价,而Na2O2中的氧元素全部由—1价升高到0价,电子转移为10个
A.高锰酸钾是氧化剂,Na2O2是还原剂,错误
B.正确
C.当产生5 mol氧气时,转移10 mol电子,故当反应产生标准状况下2.24L O2时,反应转移的电子为0.2mol,正确
D.由于高锰酸钾溶液氧化性强,可将浓盐酸氧化,而高锰酸钾溶液将被还原为氯化锰溶液,排除;
故答案为BC
由所给化学反应方程式可看出,锰元素由+7价降至+2价,而Na2O2中的氧元素全部由—1价升高到0价,电子转移为10个
A.高锰酸钾是氧化剂,Na2O2是还原剂,错误
B.正确
C.当产生5 mol氧气时,转移10 mol电子,故当反应产生标准状况下2.24L O2时,反应转移的电子为0.2mol,正确
D.由于高锰酸钾溶液氧化性强,可将浓盐酸氧化,而高锰酸钾溶液将被还原为氯化锰溶液,排除;
故答案为BC

练习册系列答案
相关题目
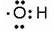
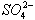
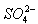 、OH—、Na+
、OH—、Na+