题目内容
如图4-4所示的两个装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得导线上通过0.02 mol电子,若不考虑盐的水解和溶液的体积变化,则下列叙述正确的是( ) 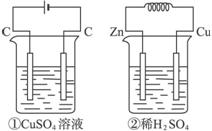
图4-4
A.产生气体的体积:①>②
B.电极上析出固体物质的质量:①>②
C.溶液pH变化:①增大,②减少
D.电极反应式:
①中阳极:4OH--4e-====2H2O+O2↑;
②中负极:2H++2e-====H2↑
解析:①为电解CuSO4溶液,两极反应分别为:
阴极:2Cu2++4e-====2Cu
阳极:4OH--4e-====2H2O+O2↑
总反应式为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
②为原电池,两极反应为:
负极:Zn-2e-====Zn2+
正极:2H++2e-====H2↑
总反应式为:Zn+H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
当通过0.02 mol电子时,①中阳极产生0.005 mol O2,②中产生0.01 mol H2;①中阴极析出0.01 mol Cu,②中没有固体析出;①电解后有H2SO4生成,溶液pH变小,②消耗H2SO4,溶液pH变大。
答案:B

练习册系列答案
相关题目



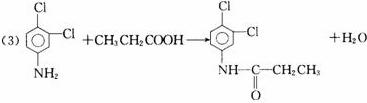
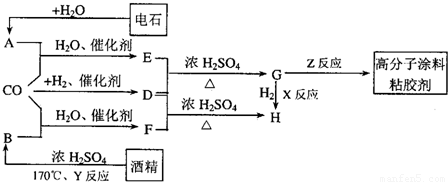
 E; ②F+D
E; ②F+D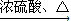 H.
H.