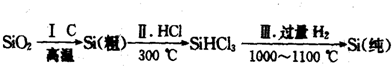题目内容
|
将7 g某铜、银合金与足量的a mol/L的HNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56 L混合,通入水中恰好完全被吸收,则此合金中铜的质量是 | |
| [ ] | |
A. |
1.6 g |
B. |
2.4 g |
C. |
3.2 g |
D. |
4.8 g |
答案:A
解析:
解析:
根据题意可以发现;铜银合金被硝酸氧化,所以失去的电子被硝酸获得,生成的还原产物(气体)与氧气混合,通入水中恰好完全吸收,产物必然是硝酸.所以,铜银合金失去的电子相当于被氧气获得.0.56 L氧气的物质的量为0.025 mol.
![]()
解得n(Cu)=0.025 mol,即铜的质量为0.025 mol×64 g/mol=1.6 g.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目