题目内容
(16分)汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示): 。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示:

① 从图中可以得出的结论是
结论一:相同温度下, 。
结论二: 。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有 。(填编号)
(3)CO的中毒是由于CO与血液中血红蛋白的血红素
部分反应生成碳氧血红蛋白(Hb·CO),在37℃时:CO+Hb·O2 O2+Hb·CO K=220
O2+Hb·CO K=220
实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也可造成人的智力损伤。抽烟后,测得平衡时人体肺部的空气中CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。请问,抽烟会造成人的智力损伤吗?(写出计算过程)
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示): 。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g)
 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);18NO2(g)+4C3H6(g)
 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示:

① 从图中可以得出的结论是
结论一:相同温度下, 。
结论二: 。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有 。(填编号)
| A.加入催化剂 | B.降低温度 |
| C.分离出H2O(g) | D.增大压强 |
部分反应生成碳氧血红蛋白(Hb·CO),在37℃时:CO+Hb·O2
 O2+Hb·CO K=220
O2+Hb·CO K=220实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也可造成人的智力损伤。抽烟后,测得平衡时人体肺部的空气中CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。请问,抽烟会造成人的智力损伤吗?(写出计算过程)
(16分)
(1)2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=2△H3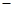 △H2
△H2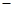 △H1
△H1
(4分;方程式、反应热各2分,配平正确但状态无写或标注错误扣1分)
(2)① 结论一: NO转化率比NO2的低 (2分)
结论二:在250°C~450°C时,NOX转化率随温度升高而增大,450°C~600°C时NOX转化率随温度升高而减小 (2分;其他合理答案也给分)
② BC (3分;只答对一个得1分,错选不给分)
(3)(5分) 肺部CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1,
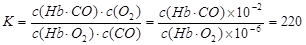 (2分)
(2分)
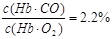 >2% (2分)
>2% (2分)
故:抽烟会造成人的智力损伤。 (1分)
(1)2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=2△H3
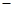 △H2
△H2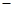 △H1
△H1(4分;方程式、反应热各2分,配平正确但状态无写或标注错误扣1分)
(2)① 结论一: NO转化率比NO2的低 (2分)
结论二:在250°C~450°C时,NOX转化率随温度升高而增大,450°C~600°C时NOX转化率随温度升高而减小 (2分;其他合理答案也给分)
② BC (3分;只答对一个得1分,错选不给分)
(3)(5分) 肺部CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1,
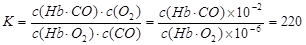 (2分)
(2分)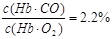 >2% (2分)
>2% (2分)故:抽烟会造成人的智力损伤。 (1分)
试题分析:(1)根据盖斯定律,目标方程式=③×2-①-②,所以所求热化学方程式为
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=2△H3
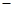 △H2
△H2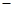 △H1
△H1(2)① 从图中可以看到,二氧化氮的转化率曲线在NO转化率曲线的上方,所以得出的结论是,相同温度时,NO转化率比NO2的低;结论二:从曲线的变化情况可知,在250°C~450°C时,NOX转化率随温度升高而增大,450°C~600°C时NOX转化率随温度升高而减小;同时也可以说明,温度升高NOX转化率降低,则NOX转化反应是放热反应;
②A、加入催化剂,只能加快反应速率,不能改变平衡,所以二氧化氮的转化率不会提高,错误;B、有①的分析知该反应是放热反应,降低温度,平衡正向移动,二氧化氮的转化率提高,正确;C、分离出水蒸气,使生成物浓度降低,平衡正向移动,提高二氧化氮的转化率,正确;D、增大压强,平衡逆向移动,二氧化氮的转化率降低,错误,答案选BC;
(3)由K=220可知,220=c(O2)c(Hb·CO)/ c(Hb·O2) c(CO),CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。所以c(Hb·CO)/ c(Hb·O2)=220×10-6 mol·L-1/10-2 mol·L-1=2.2%>2%,所以抽烟会造成人的智力损伤。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
 时间/min
时间/min
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。

 CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L
CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L 则Q1和Q2的关系为( )
则Q1和Q2的关系为( )