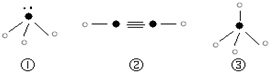
题目内容
下列离子中,电子数大于质子数,且质子数大于中子数的是( )
A.H3O+ B.Li+ C.OH- D.Na+
【答案】
C
【解析】
试题分析:A中电子数是10,质子数是11,中子数是8;B中电子数是2,质子数是3,中子数是3;C中电子数是10,质子数是9,中子数是8;D中电子数是10,质子数是11,中子数是11,答案选C。
考点:考查中子数、质子数、电子数的有关计算
点评:本题是常识性知识的考查,也是高考中的常见题型之一,难度不大。主要是检验学生对有关概念的理解,培养学生严谨的思维能力。

练习册系列答案
相关题目
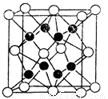
 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:


 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“