题目内容
(2013?漳州二模)生铁中含碳和硫等元素.化学兴趣小组对某生铁样品进行了探究.根据要求回答下列问题.生铁中碳和硫元素的定性检验按如图装置进行实验(夹持仪器已略去,填接口字母代号)可以实现碳和硫元素的检验.
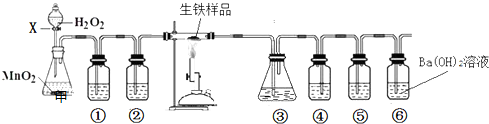
(1)仪器X的名称是
(2)写出甲中反应的化学方程式
(3)如果撤除装置③④⑤,能否确认生铁样品中碳元素的存在?
生铁中碳、硫质量分数的测定:
(4)甲同学认为,以上装置可以粗略测定样品中碳的含量.称取样品w1g进行实验,充分反应后,测得装置⑥中生成的沉淀为w2g,该样品中碳的质量分数为
(用含w1、w2的式子表示).
(5)乙同学认为,待一定量样品充分反应后,向装置④中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案测得的结果

(1)仪器X的名称是
分液漏斗
分液漏斗
;装置③、⑤中试剂相同,装置④中盛放的试剂是酸性高锰酸钾溶液(或溴水)
酸性高锰酸钾溶液(或溴水)
.(2)写出甲中反应的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(3)如果撤除装置③④⑤,能否确认生铁样品中碳元素的存在?
不能
不能
,理由是SO2也能使氢氧化钡溶液变浑浊
SO2也能使氢氧化钡溶液变浑浊
.生铁中碳、硫质量分数的测定:
(4)甲同学认为,以上装置可以粗略测定样品中碳的含量.称取样品w1g进行实验,充分反应后,测得装置⑥中生成的沉淀为w2g,该样品中碳的质量分数为
| 12w2 |
| 197w1 |
| 12w2 |
| 197w1 |
(5)乙同学认为,待一定量样品充分反应后,向装置④中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案测得的结果
偏小
偏小
(填“偏大”、“偏小”);若要提高硫元素含量的测定精度,在不改变实验原理的前提下,可以采取的一种措施是反应结束后,继续同入氧气一段时间且将③中溶液加热到变为红色
反应结束后,继续同入氧气一段时间且将③中溶液加热到变为红色
.分析:由探究装置图可知,甲中生成氧气,①②为除杂装置,然后C、S燃烧生成二氧化碳、二氧化硫,③⑤为品红溶液,④为除去二氧化硫的装置,⑥可检验二氧化碳,
(1)由图分析仪器,由④中二氧化硫被反应掉,选择试剂;
(2)双氧水分解生成水和氧气;
(3)二氧化碳、二氧化硫均使氢氧化钡溶液变浑浊;
(4)装置⑥中生成的沉淀为w2g,为碳酸钡质量,利用C~CO2~BaCO3计算;
(4)二氧化硫与氯化钡不反应,将亚硫酸根离子氧化为硫酸根离子,再与氯化钡反应生成硫酸钡沉淀,可测定S元素的含量.
(1)由图分析仪器,由④中二氧化硫被反应掉,选择试剂;
(2)双氧水分解生成水和氧气;
(3)二氧化碳、二氧化硫均使氢氧化钡溶液变浑浊;
(4)装置⑥中生成的沉淀为w2g,为碳酸钡质量,利用C~CO2~BaCO3计算;
(4)二氧化硫与氯化钡不反应,将亚硫酸根离子氧化为硫酸根离子,再与氯化钡反应生成硫酸钡沉淀,可测定S元素的含量.
解答:解:由探究装置图可知,甲中生成氧气,①②为除杂装置,然后C、S燃烧生成二氧化碳、二氧化硫,③⑤为品红溶液,④为除去二氧化硫的装置,⑥可检验二氧化碳,
(1)由图可知仪器X为分液漏斗,由④中二氧化硫被反应掉,选择试剂为酸性高锰酸钾溶液(或溴水),故答案为:分液漏斗;酸性高锰酸钾溶液(或溴水);
(2)双氧水分解生成水和氧气,该反应为2H2O2
2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑;
(3)撤除装置③④⑤,二氧化碳、二氧化硫均使氢氧化钡溶液变浑浊,则不能确认生铁样品中碳元素的存在,故答案为:不能;SO2也能使氢氧化钡溶液变浑浊;
(4)装置⑥中生成的沉淀为w2g,为碳酸钡质量,由C~CO2~BaCO3可知,该样品中碳的质量分数为
×100%=
,故答案为:
;
(4)二氧化硫与氯化钡不反应,将亚硫酸根离子氧化为硫酸根离子,再与氯化钡反应生成硫酸钡沉淀,可测定S元素的含量,则向装置④中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案测得的结果偏小,应采取措施为反应结束后,继续同入氧气一段时间且将③中溶液加热到变为红色,
故答案为:偏小;反应结束后,继续同入氧气一段时间且将③中溶液加热到变为红色.
(1)由图可知仪器X为分液漏斗,由④中二氧化硫被反应掉,选择试剂为酸性高锰酸钾溶液(或溴水),故答案为:分液漏斗;酸性高锰酸钾溶液(或溴水);
(2)双氧水分解生成水和氧气,该反应为2H2O2
| ||
| ||
(3)撤除装置③④⑤,二氧化碳、二氧化硫均使氢氧化钡溶液变浑浊,则不能确认生铁样品中碳元素的存在,故答案为:不能;SO2也能使氢氧化钡溶液变浑浊;
(4)装置⑥中生成的沉淀为w2g,为碳酸钡质量,由C~CO2~BaCO3可知,该样品中碳的质量分数为
| ||
| w1g |
| 12w2 |
| 197w1 |
| 12w2 |
| 197w1 |
(4)二氧化硫与氯化钡不反应,将亚硫酸根离子氧化为硫酸根离子,再与氯化钡反应生成硫酸钡沉淀,可测定S元素的含量,则向装置④中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案测得的结果偏小,应采取措施为反应结束后,继续同入氧气一段时间且将③中溶液加热到变为红色,
故答案为:偏小;反应结束后,继续同入氧气一段时间且将③中溶液加热到变为红色.
点评:本题探究生铁中C、S的测定,把握实验装置及装置中各部分的作用、发生的化学反应为解答的关键,侧重定性分析及定量计算的考查,注意(4)中要求学生具有严密的思维,明确二氧化硫的性质即可解答,题目难度中等.

练习册系列答案
相关题目

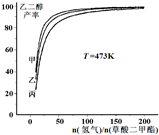 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=


