题目内容
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
(1)F元素价层电子排布式为______.
(2)关于B2A2的下列说法中正确的是______.
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s-spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是______.
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因______.
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有______ 键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,则M的电子式为______,N的结构式为______.
(6)E的氢化物的价层电子对互斥理论模型为______,E 原 子的杂化方式为______杂化.
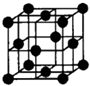
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______,F原子配位数之比为______.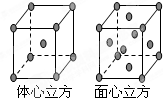
(1)F元素价层电子排布式为______.
(2)关于B2A2的下列说法中正确的是______.
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s-spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是______.
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因______.
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有______ 键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,则M的电子式为______,N的结构式为______.
(6)E的氢化物的价层电子对互斥理论模型为______,E 原 子的杂化方式为______杂化.
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______,F原子配位数之比为______.

已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,A为氢元素,B原子最外层电子数是内层电子数的2倍,B有2个电子层,最外层电子数为4,故B为碳元素,D、E为同主族元素,且E的原子序数为D的2倍,D为氧元素,E为硫元素,故C为氮元素,F元素在地壳中含量位于金属元素的第二位,F为Fe元素,
(1)Fe元素是26号元素,价层电子排布式为3d64s2,故答案为:3d64s2;
(2)B2A2为C2H2,
A、分子中H原子不满足8电子结构,故A错误;
B、含有2个C-H键、1个C≡C三键,单键为σ键,三键中含有1个σ键、2个π键,σ键与π键之比为3:2,故B错误;
C、C-H为极性键,C≡C三键是非极性键,为对称结构,属于非极性分子,故C正确;
D、分子中C原子采取sp杂化,故C-H键为s-spσ键,故D正确;
故答案为:CD;
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则为CO2与N2O,CO2是直线型,
故答案为:直线型;
(4)N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定,失去第一的电子需要的能量比C、O多,
故答案为:N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定;
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,X为H2O,Y为H2O2,Y中含有O-H键,是极性键,含有O-O键为非极性键,
A与C组成的两种化合物M和N所含的电子数分别与X、Y相,则M为NH3,电子式为
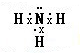
,N为N2H4,结构式为
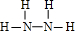
,
故答案为:极性键、非极性键;
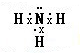
;
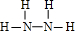
;
(6)E的氢化物为H2S,S原子成2个S-H键,含有2对孤电子对,价层电子对为4,价层电子对互斥理论模型为四面体型,S原子的杂化方式为SP3杂化,故答案为:四面体型,SP3;
(7)面心立方晶胞边长为acm,体积V=a3,含有Fe原子数目为8×
+6×
=4,故a3ρ(面心)=4×
,
体心立方晶胞边长为bcm,体积V=b3,含有Fe原子数目为8×
+1=2,故b3ρ(体心)=2×
,故ρ(面心):ρ(体心)=2b3:a3.
面心立方晶胞中每个Fe原子周围有12个Fe原子,体心立方晶胞中每个Fe原子周围有8个Fe原子,故Fe原子配位数之比为12:8=3:2,
故答案为:2b3:a3;3:2.
(1)Fe元素是26号元素,价层电子排布式为3d64s2,故答案为:3d64s2;
(2)B2A2为C2H2,
A、分子中H原子不满足8电子结构,故A错误;
B、含有2个C-H键、1个C≡C三键,单键为σ键,三键中含有1个σ键、2个π键,σ键与π键之比为3:2,故B错误;
C、C-H为极性键,C≡C三键是非极性键,为对称结构,属于非极性分子,故C正确;
D、分子中C原子采取sp杂化,故C-H键为s-spσ键,故D正确;
故答案为:CD;
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则为CO2与N2O,CO2是直线型,
故答案为:直线型;
(4)N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定,失去第一的电子需要的能量比C、O多,
故答案为:N元素原子2p能级有3个电子,为半满稳定状态,能量较低,较稳定;
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,X为H2O,Y为H2O2,Y中含有O-H键,是极性键,含有O-O键为非极性键,
A与C组成的两种化合物M和N所含的电子数分别与X、Y相,则M为NH3,电子式为
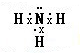
,N为N2H4,结构式为
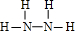
,
故答案为:极性键、非极性键;
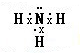
;
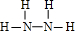
;
(6)E的氢化物为H2S,S原子成2个S-H键,含有2对孤电子对,价层电子对为4,价层电子对互斥理论模型为四面体型,S原子的杂化方式为SP3杂化,故答案为:四面体型,SP3;
(7)面心立方晶胞边长为acm,体积V=a3,含有Fe原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 56 |
| NA |
体心立方晶胞边长为bcm,体积V=b3,含有Fe原子数目为8×
| 1 |
| 8 |
| 56 |
| NA |
面心立方晶胞中每个Fe原子周围有12个Fe原子,体心立方晶胞中每个Fe原子周围有8个Fe原子,故Fe原子配位数之比为12:8=3:2,
故答案为:2b3:a3;3:2.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: