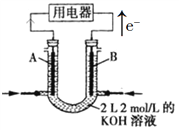
题目内容
【题目】根据所学知识完成题目:
(1)根据氧化还原反应2H2+O2═2H2O,设计成燃料电池,负极通的气体应是 , 正极通的气体应是 .
(2)根据选择电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应式 |
|
|
正极反应式 |
|
|
溶液的pH变化 |
|
|
(3)若把H2改为CH4 , KOH作电解质,则负极反应式为 .
【答案】
(1)H2;O2
(2)H2﹣2e﹣=2H+;H2﹣2e﹣+2OH﹣=2H2O;O2+4H++4e﹣=2H2O;O2+2H2O+4e﹣=4OH﹣;增大;减小
(3)CH4+10OH﹣﹣8e﹣=CO ![]() +7H2O
+7H2O
【解析】解:(1)根据电池反应式可知在反应中H2被氧化,O2被还原.H2应该在负极上反应,O2应该在正极上反应,所以答案是:H2;O2;(2)酸性溶液,此时应考虑不可能有OH﹣生成,所以负极发生氧化反应,电极反应为H2﹣2e﹣=2H+ , 正极发生还原反应,电极反应为O2+4H++4e﹣=2H2O,生成水导致氢离子浓度减少,pH增大,所以H2SO4溶液:负极:H2﹣2e﹣=2H+;正极:O2+4H++4e﹣=2H2O;溶液的pH变化:增大;H2应该在负极上反应,O2应该在正极上反应,正极的电极反应为O2+2H2O+4e﹣=4OH﹣;又因为是碱性溶液,不可能有H+参加或生成,故负极的电极反应为H2﹣2e﹣+2OH﹣=2H2O,生成水导致氢氧根离子的浓度减小,所以溶液的pH减小,所以KOH溶液:负极:H2﹣2e﹣+2OH﹣=2H2O;正极:O2+2H2O+4e﹣=4OH﹣;溶液的pH变化:减小,所以答案是:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应式 | H2﹣2e﹣=2H+ | H2﹣2e﹣+2OH﹣=2H2O |
正极反应式 | O2+4H++4e﹣=2H2O | O2+2H2O+4e﹣=4OH﹣ |
溶液的pH变化 | 增大 | 减小 |
;(3)如把H2改为甲烷,KOH溶液做电解质,氧气在正极得到电子生成氢氧根离子,则正极为2O2+4H2O+8e﹣=8OH﹣ , 甲烷失电子在碱溶液中反应,甲烷在负极失电子发生氧化反应在碱溶液中生成碳酸盐,此时不会有CO2放出;负极为CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣=CO ![]() +7H2O.
+7H2O.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案