题目内容
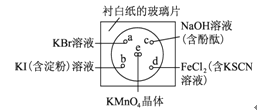
【题目】某学生社团根据老师的指导进行实验研究:一块下衬白纸的玻璃片上有a、b、c、d四个位置,分别滴加浓度为0.1 mol/L的四种溶液各1滴,每种彼此分开,形成一个个小液滴。在圆心e处放置2粒芝麻粒大小的KMnO4晶体,然后向KMnO4晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。
完成下列填空:
(1).e处立即发生反应,化学方程式如下,请配平,并标出电子转移方向和数目。___________
![]() KMnO4+
KMnO4+![]() HCl(浓)→
HCl(浓)→![]() KCl+
KCl+![]() MnCl2+
MnCl2+![]() Cl2↑+
Cl2↑+![]() H2O
H2O
(2).在元素周期表中Cl、Br、I位于___________________ 族 ,它们最高价氧化物所对应水化物酸性最强的是__________________(填化学式)。
(3).b处实验现象为________________________。d处反应的离子方程式为____________________________________________,通过此实验________(填“能”或“不能”)比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是___________________________________。
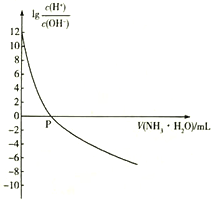
(4).常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是________
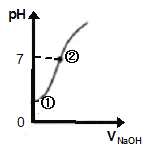
A.①处所示溶液中存在的电离平衡不止一个
B.由①到②的过程中,溶液由酸性逐渐变为碱性
C.由①到②的过程中,水的电离程度逐渐减弱
D.②处所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
【答案】  ⅦA族 HClO4 由无色变为蓝色 Cl2+2Fe2+→2 Cl-+ 2Fe3+ 能 KMnO4>Cl2>FeCl3 A、D
ⅦA族 HClO4 由无色变为蓝色 Cl2+2Fe2+→2 Cl-+ 2Fe3+ 能 KMnO4>Cl2>FeCl3 A、D
【解析】(1)反应中Mn元素的化合价由+7降低为+2,得到的电子为(7-2)e-=5e-,Cl元素的化合价由-1升高为0,失去的电子为2×(1-0)e-=2e-,根据化合价升降守恒,KMnO4配上系数2,氯气配上系数5,再通过观察法配平,得:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7降低为+2,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,失去的电子为5×2×(1-0)e-=10e-,单线桥标出反应中电子的转移方向和数目为![]() ,故答案为:
,故答案为:![]() ;
;
(2)Cl、Br、I最外层均为7个电子,在元素周期表中均位于ⅦA族,元素的非金属性越强,最高价氧化物所对应水化物酸性越强,酸性最强的是HClO4,故答案为:ⅦA;HClO4;
(3)在圆心e处放置2粒芝麻粒大小的KMnO4晶体,然后向KMnO4晶体滴加一滴浓盐酸,浓盐酸与高锰酸钾反应放出氯气。b处氯气能置换出碘,2KI+Cl2═2KCl+I2,碘遇淀粉变蓝色,d处发生的反应为:2FeCl2+Cl2═2FeCl3,离子方程式为Cl2+2Fe2+=2 Cl-+2Fe3+,Fe3+和SCN-反应使溶液变红色。e处实验说明氧化性KMnO4>Cl2,d处实验说明氧化性Cl2>FeCl3,因此,三种物质氧化性强弱顺序为KMnO4>Cl2>FeCl3,故答案为:由无色变为蓝色;Cl2+2Fe2+=2 Cl-+2Fe3+;能;KMnO4>Cl2>FeCl3;
(4)A.①点时没有加入氢氧化钠,溶液中存在HClO和水的电离平衡,故A正确;B.根据图像,由①到②的过程中,溶液由酸性逐渐减弱,直至中性,没有变成碱性,故B错误;C.①到②溶液c(H+)之间减小,酸对水的电离的抑制程度减小,则水的电离程度逐渐增大,故C错误;D.②点时溶液pH=7,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+) =c(Cl-)+c(ClO-) +c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故D正确;故选AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案