题目内容
【题目】硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________。硫所在周期中,第一电离能最大的元素是___________。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________。
(3)H2S中S原子的杂化类型是__________;H2S的VSEPR模型名称为_________;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________个配位键,___________个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____cm。
【答案】 跃迁 1s22s22p6 3s13p5 Ar 略 sp3 四面体形 氧与硫同族,硫的电负性更小,对氢原子的吸引力更弱,氢原子离核越远,相应的2根H—S键的成键电子对之间的排斥就更小,所以键角H2S<H2O 4 4 【答题空10】Zn2+比Hg2+离子半径小,ZnS晶格能大于HgS,所以熔点较高,先析出 4 ![]() ρNAr2
ρNAr2
【解析】(1)当基态原子的电子吸收能量后,电子会发生跃迁,激发态的S原子,其中1个3s电子跃迁到3p轨道,该激发态S原子的核外电子排布式为:1s22s22p63s13p5,同周期中从左向右,元素的非金属性增强,第一电离能增强,同周期中稀有气体元素的第一电离能最大,所以在第3周期中,第一电离能最大的元素为Ar,故答案为:跃迁;1s22s22p63s13p5;Ar;
(2)与CO2具有相同空间结构和键合形式的分子可以是二硫化碳,为电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)H2S中S的中心原子中含有2个孤电子对和2个σ键,杂化轨道数2+2=4,硫原子采取sp3杂化;H2S的VSEPR模型名称四面体形,氧与硫同族,硫的电负性更小,对氢原子的吸引力更弱,氢原子离核越远,相应的2根H—S键的成键电子对之间的排斥就更小,所以键角H2S<H2O,故答案为:sp3;四面体形;氧与硫同族,硫的电负性更小,对氢原子的吸引力更弱,氢原子离核越远,相应的2根H—S键的成键电子对之间的排斥就更小,所以键角H2S<H2O;
(4)铜离子与水分子之间形成配位键,水分子之间形成氢键、水分子与硫酸根离子之间也形成氢键,图中微粒中含有 4个配位键,4个氢键,故答案为:4;4;
(5)二者均为离子晶体,Zn2+比Hg2+离子半径小,ZnS晶格能大于HgS,因此ZnS所以熔点较高,先析出,故答案为:Zn2+比Hg2+离子半径小,ZnS晶格能大于HgS,所以熔点较高,先析出;
(6)由图可知石墨的晶胞结构为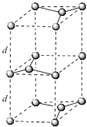 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为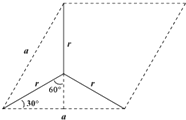 ,则
,则![]() =r×sin60°,可得a=
=r×sin60°,可得a=![]() r,则底面面积为(
r,则底面面积为(![]() r)2×Sin60°,晶胞中C原子数目为1+2×
r)2×Sin60°,晶胞中C原子数目为1+2×![]() +8×
+8×![]() +4×
+4×![]() =4,晶胞质量为
=4,晶胞质量为![]() g,则:ρg·cm-3=
g,则:ρg·cm-3=![]() g÷[(
g÷[(![]() r)2×Sin60°×2d]cm3,整理可得d=
r)2×Sin60°×2d]cm3,整理可得d=![]() ρNAr2,故答案为:4;
ρNAr2,故答案为:4; ![]() ρNAr2。
ρNAr2。

【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
A. A B. B C. C D. D