题目内容
【题目】在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
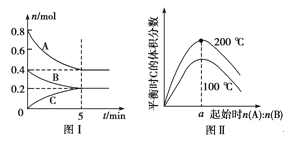
A.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5
【答案】B
【解析】
试题分析:A.由图像可知:升高温度,平衡时C的体积分数增大,说明升高温度化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,则正反应方向为吸热反应。所以△H>0,根据图Ⅰ所示可知该反应的方程式为2A+B![]() C,只有当两种反应物按照方程式的计量数的关系加入时生成物C达到平衡时含量才会最高,则a=2,A错误;B.200℃时,反应从开始到平衡的平均速率v(B)={(0.4-0.2) mol÷2 L}÷5 min=0.02 mol/(L·min),B正确;C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,由于平衡混合物中各组分的浓度没变,所以平衡不移动,v(正)=v(逆),C错误;D.由图Ⅰ可知在200℃时,若加入0.8mol A和0.4mol B,达到平衡时A的含量为0.5。若向容器中充入2 mol A 和1 mol B,即增大了反应物的浓度,同时容器内气体的压强增大。根据平衡移动原理:增大压强,化学平衡向正反应方向移动。所以达到平衡时,A 的体积分数小于0.5,D错误;答案选B。
C,只有当两种反应物按照方程式的计量数的关系加入时生成物C达到平衡时含量才会最高,则a=2,A错误;B.200℃时,反应从开始到平衡的平均速率v(B)={(0.4-0.2) mol÷2 L}÷5 min=0.02 mol/(L·min),B正确;C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,由于平衡混合物中各组分的浓度没变,所以平衡不移动,v(正)=v(逆),C错误;D.由图Ⅰ可知在200℃时,若加入0.8mol A和0.4mol B,达到平衡时A的含量为0.5。若向容器中充入2 mol A 和1 mol B,即增大了反应物的浓度,同时容器内气体的压强增大。根据平衡移动原理:增大压强,化学平衡向正反应方向移动。所以达到平衡时,A 的体积分数小于0.5,D错误;答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】A和B两种有机物可以互溶,有关性质如下
密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用________方法即可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应消耗氧气6.72L(标准状况),生成5.4g H2O和8.8g CO2,则该物质的分子式是______;已知有机物A的核磁共振氢谱如下图所示,则A的结构简式为_______________。以A为原料可以合成M,M可做内燃机的抗冻剂,M与A所含碳原子数相等,M的官能团与A相同,但官能团数目是A的两倍,请写出以A为原料制取M的合成路线:_______________。

(3)若质谱图显示B的相对分子质量为74,红外光谱如图所示,则B的结构简式为____________。

(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重14.4g和26.4g。计算混合物中A和B的物质的量之比___________。