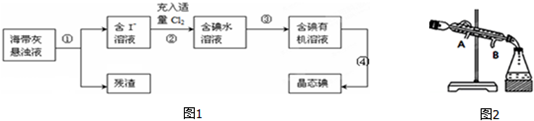
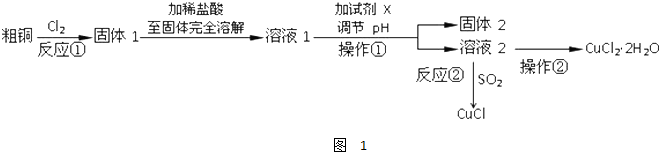
题目内容
16.下列有关离子共存的说法或离子方程式的书写中,正确的一组是( )①通入大量NH3后的溶液中能大量共存的离子:NH4+、Al3+、Cl-、SO42-
②pH=1的溶液中能大量共存的离子:Fe3+、Mg2+、Cl-、SO42-
③水电离出的c(H+)=1×10-12 mol/L溶液中可能大量共存的离子:K+、CO32-、Na+、S2
④向NH4HCO3溶液中加入足量NaOH溶液并共热:NH4++OH-=NH3↑+H2O
⑤用食醋溶解水垢:CaCO3+2H+=Ca2++CO2↑+H2O
⑥向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
⑦用FeCl3溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+.
| A. | ①③⑤⑦ | B. | ②④⑤⑦ | C. | ②③⑥⑦ | D. | ③④⑥⑦ |
分析 ①通入大量NH3后的溶液中OH-能分别与NH4+、Al3+反应;
②pH=1的溶液中存在大量氢离子,该组离子之间不反应,都不与氢离子反应;
③水电离出的c(H+)=1×10-12 mol/L溶液中,可能为酸或碱溶液,酸溶液中H+分别与CO32-、S2-能反应;
④加入足量NaOH溶液,碳酸氢根和铵根离子都参与反应;
⑤醋酸为弱酸,离子方程式中醋酸不能拆开;
⑥硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,硫酸氢钠与氢氧化钡按照物质的量2:1反应;
⑦铁离子与铜反应生成亚铁离子和铜离子.
解答 解:①通入大量NH3后的溶液中显碱性,OH-能分别与NH4+、Al3+结合,则不能共存,故①错误;
②pH=1的溶液中该组离子之间不反应,则能大量共存的离子,故②正确;
③水电离出的c(H+)=1×10-12 mol/L溶液中,水的电离受到抑制,可能为酸或碱溶液,酸溶液中H+分别与CO32-、S2-能反应,则不能大量共存,故③错误;
④NH4HCO3溶液加入足量NaOH溶液共热生成碳酸钠、氨气和水,则离子反应为HCO3-+NH4++2OH-═NH3↑+H2O+CO32-,故④错误;
⑤碳酸钙和醋酸都不能拆开,用食醋溶解水垢的离子反应为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故⑤错误;
⑥硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,反应生成硫酸钡、硫酸钠和水,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故⑥正确;
⑦用FeCl3溶液腐蚀铜电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,遵循电荷守恒和质量守恒定律,故⑦正确;
故选C.
点评 本题考查离子的共存、离子方程式的书写判断,题目浓度中等,明确离子反应发生条件及离子方程式的书写原则为解答关键,试题知识点较多,充分考查学生的灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 质量分数 | B. | 物质的量 | C. | 摩尔质量 | D. | 物质的量浓度 |
| A. | 分子中含有碳元素和氢元素的化合物是烃类 | |
| B. | 相对分子质量相同的物质一定是同种物质 | |
| C. | 相对分子质量相差14的两种有机物,一定是属于同系物 | |
| D. | 分子式相同结构不同的有机物一定是同分异构体 |
| A. | 食盐用于制纯碱 | B. | 硅藻土作吸咐剂 | ||
| C. | 用硫酸铜配制农药 | D. | 乙二醇作医用消毒剂 |
| A. | HCO3- | B. | Al3+ | C. | CH3COO- | D. | H2PO4- |
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(3)⑧的原子结构示意图为
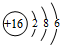 ,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.
,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为34.(4)若要证明非金属性:⑨>碘,可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为变蓝,即可证明.

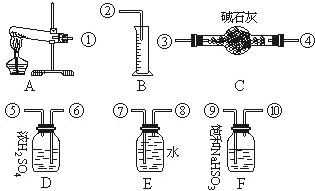 CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示:
CuSO4在一定条件下发生如下分解:CuSO4═CuO+SO2+SO3+O2,有人设计通过实验测定反应产生的SO2,SO3,O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数.实验可能需要的仪器如图所示: