题目内容
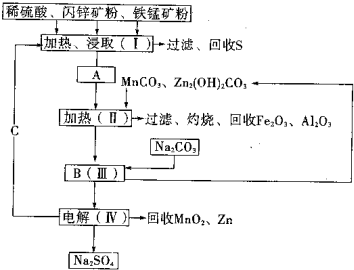 某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4
(1)A中属于还原产物的是______.
(2)Ⅱ中加入MnCO3、Zn2(OH)2CO3的作用是______;
Ⅱ需要加热的原因是______;C的化学式是______.
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______.
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.
(5)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______.
解:(1)比较信息①,A与软锰矿中元素化合价的变化可知,锰元素化合价从+4价降低为+2价,所以A中还原产物为MnSO4,故答案为:MnSO4;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝,所以加入MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全,在加热的环境下,金属阳离子的水解更彻底,更易形成沉淀而分离,根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知C为硫酸,
故答案为:增大溶液的PH,使Fe3+和Al3+均生成沉淀;促进Fe3+和Al3+的水解;H2SO4;
(3)该实验的目的就是制备二氧化锰与锌,因而就需要把氧化铝、铁元素、硫元素除去.根据流程图不难得出该生产中除得到MnO2和Zn以外,还可得到的副产品有硫、氧化铁、氧化铝,故答案为:Fe2O3、Al2O3、S、Na2SO4;
(4)根据框图中转化消耗的反应物,如果不考虑生产中的损耗,除矿石外,需购买的化工原料是氢氧化钠和硫酸,故答案为:纯碱和硫酸;
(5)据反应MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4可知MnO2、Zn的物质的量之比为1:1,故可设软锰矿、闪锌矿的质量分别为x、y,得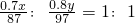 ,故x:y=1.03,故答案为:1.03.
,故x:y=1.03,故答案为:1.03.
分析:(1)在氧化还原反应中,化合价降低元素所在的产物是还原产物;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝;
(3)根据转化过程中发生的反应来确定得到的副产品;
(4)格局框图中要加入的物质可以确定工厂需要购买的化工原料;
(5)根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知MnO2、Zn的物质的量之比为1:1来计算即可.
点评:本题是一道有关化工生产工艺的综合知识题目,考查角度广,难度大.
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝,所以加入MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全,在加热的环境下,金属阳离子的水解更彻底,更易形成沉淀而分离,根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知C为硫酸,
故答案为:增大溶液的PH,使Fe3+和Al3+均生成沉淀;促进Fe3+和Al3+的水解;H2SO4;
(3)该实验的目的就是制备二氧化锰与锌,因而就需要把氧化铝、铁元素、硫元素除去.根据流程图不难得出该生产中除得到MnO2和Zn以外,还可得到的副产品有硫、氧化铁、氧化铝,故答案为:Fe2O3、Al2O3、S、Na2SO4;
(4)根据框图中转化消耗的反应物,如果不考虑生产中的损耗,除矿石外,需购买的化工原料是氢氧化钠和硫酸,故答案为:纯碱和硫酸;
(5)据反应MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4可知MnO2、Zn的物质的量之比为1:1,故可设软锰矿、闪锌矿的质量分别为x、y,得
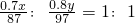 ,故x:y=1.03,故答案为:1.03.
,故x:y=1.03,故答案为:1.03.分析:(1)在氧化还原反应中,化合价降低元素所在的产物是还原产物;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝;
(3)根据转化过程中发生的反应来确定得到的副产品;
(4)格局框图中要加入的物质可以确定工厂需要购买的化工原料;
(5)根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知MnO2、Zn的物质的量之比为1:1来计算即可.
点评:本题是一道有关化工生产工艺的综合知识题目,考查角度广,难度大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
请设计CO2在高温下与木炭反应生成CO的实验.
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,在答题卡上填写该表
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
(4)验证CO的方法是______.
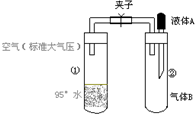 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的