题目内容
(2010?丰台区二模)下列说法中不正确的是( )
分析:A、温度越高,水的电离程度越大,氢离子浓度增大,但纯水中c(H+)=c(OH-).
B、氨水和盐酸混合后溶液呈酸性,可能为氯化铵溶液或氯化铵、盐酸混合溶液,也可能是氨水与氯化铵混合溶液.
C、pH=-logc(H+),pH=2的醋酸溶液与pH=2盐酸中c(H+)相等.
D、Mg(OH)2沉淀存在溶解平衡Mg(OH)2(s)?Mg2++2OH-,加入NH4Cl浓溶液,存在平衡NH4++OH-?NH3?H2O,OH-浓度降低,促进Mg(OH)2溶解.
B、氨水和盐酸混合后溶液呈酸性,可能为氯化铵溶液或氯化铵、盐酸混合溶液,也可能是氨水与氯化铵混合溶液.
C、pH=-logc(H+),pH=2的醋酸溶液与pH=2盐酸中c(H+)相等.
D、Mg(OH)2沉淀存在溶解平衡Mg(OH)2(s)?Mg2++2OH-,加入NH4Cl浓溶液,存在平衡NH4++OH-?NH3?H2O,OH-浓度降低,促进Mg(OH)2溶解.
解答:解:A、温度越高,水的电离程度越大,H+、OH-浓度增大,但纯水中c(H+)=c(OH-),故水的离子积变大,pH减小,但仍呈中性,故A正确;
B、氨水和盐酸混合后溶液呈酸性,若为氯化铵溶液,NH4+水解程度很小,c(NH4+)>c(H+);若为氯化铵、盐酸混合溶液,浓度盐酸≥氯化铵,则c(NH4+)<c(H+),故B错误;
C、pH=-logc(H+),pH=2的醋酸溶液与pH=2盐酸中c(H+)相等,故C正确;
D、Mg(OH)2沉淀存在溶解平衡Mg(OH)2(s)?Mg2++2OH-,加入NH4Cl浓溶液,存在平衡NH4++OH-?NH3?H2O,OH-浓度降低,促进Mg(OH)2溶解,沉淀会逐渐溶解,故D正确.
故选:B.
B、氨水和盐酸混合后溶液呈酸性,若为氯化铵溶液,NH4+水解程度很小,c(NH4+)>c(H+);若为氯化铵、盐酸混合溶液,浓度盐酸≥氯化铵,则c(NH4+)<c(H+),故B错误;
C、pH=-logc(H+),pH=2的醋酸溶液与pH=2盐酸中c(H+)相等,故C正确;
D、Mg(OH)2沉淀存在溶解平衡Mg(OH)2(s)?Mg2++2OH-,加入NH4Cl浓溶液,存在平衡NH4++OH-?NH3?H2O,OH-浓度降低,促进Mg(OH)2溶解,沉淀会逐渐溶解,故D正确.
故选:B.
点评:考查水的电离、溶液中离子浓度的比较、PH值计算,平衡移动等,难度中等,注意D选项中氯化铵呈酸性中和氢氧根是次要的因素,不能据此解释Mg(OH)2溶解.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
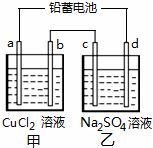 (2010?丰台区二模)用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
(2010?丰台区二模)用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为: