题目内容
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是种无色气体,具有轻微的醚香味,其燃烧热为1455kJ·mol-1,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式_______________________。
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+H2O(g) △H<0 —定温度下,在一个固定体积的密闭容器中进行该反应,下列能判断反应达到化学平衡状态的是____(选填编号,注意大小写)。
CH3OCH3(g)+H2O(g) △H<0 —定温度下,在一个固定体积的密闭容器中进行该反应,下列能判断反应达到化学平衡状态的是____(选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有lmolH2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。请写出该电池中负极上的电极反应式是:________________________。
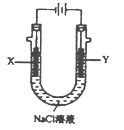
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mLNaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是____________;当燃料电池消耗2.8LO2 (标准状况下)时,计算此时:NaCl溶液中C(OH-)=______________mol/L (假设溶液的体积不变,气体全部从溶液中逸出)。
【答案】 CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H1=-1455kJ/mol ad CH3OCH3+16OH﹣-12e﹣=2CO32﹣+11H2O Y电极附近溶液中有气体产生,上部分呈黄绿色 1
【解析】本题主要考查电解池原理。
(1)燃烧热对应1mol甲醚,甲醚燃烧的热化学方程式:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H1=-1455kJ/mol。
(2)a.c(H2)与c(H2O)的比值随着反应进行而变化,当保持不变时表明反应达到平衡状态;b.都是正反应速率,不能判断反应达到平衡状态;c.容器中气体的质量、体积不变,气体密度保持不变,不能判断反应达到平衡状态;d.容器中气体压强随着反应进行而改变,不再改变时,表明反应达到平衡状态。故选ad。
(3)负极发生氧化反应,生成CO32﹣、H2O,该电池中负极上的电极反应式是:CH3OCH3+16OH﹣-12e﹣=2CO32﹣+11H2O。
(4)Y是阳极,在阳极上,氯离子被氧化为氯气,电解过程中Y电极附近观察到的现象是Y电极附近溶液中有气体产生,上部分呈黄绿色;2.8LO2的物质的量为2.8/22.4mol=0.125mol,O2~4e-~4OH-,NaCl溶液中生成0.5molOH-,C(OH-)=0.5/0.5mol/L=1mol/L。

 科学实验活动册系列答案
科学实验活动册系列答案