题目内容
【题目】利用下图装罝制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是—种高效氧化剂、漂白剂)。己知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaC1O2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
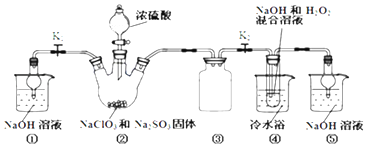
完成下列填空:
(1)装置②中产生ClO2的化学方程式为________。装置④中发生反应的离子方程式为_______。
(2)装置③的作用是_____________________。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②___;③___;④低于60℃干燥,得到成品。
(4)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤:③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因______________________。
(5)①亚氯酸钠纯度测定:准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。②取25.00mL待测液,恰好与20mL 2.0mol·L-1 Na2S2O3完全反应(I2 +2S2O32-=2I-+S4O62-),则该样品中NaClO2的质量分数为___。
【答案】 2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O 2ClO2+H2O2+2OH =2ClO2 +2H2O+O2↑ 防止倒吸 过滤 洗涤 防止生成NaClO2·3H2O晶体和温度过高产品分解 90.5%
【解析】本题主要考查对于制备亚氯酸钠实验的评价。
(1)装置②中产生ClO2,NaClO3→ClO2,Na2SO3→Na2SO4,反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O。装置④中,ClO2→NaClO2,H2O2→O2,发生反应的离子方程式为2ClO2+H2O2+2OH=2ClO2+2H2O+O2↑。
(2)装置③的作用是防止倒吸。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②过滤;③洗涤;④低于60℃干燥,得到成品。
(4)步骤③中用50℃左右的温水洗涤的原因:防止温度过低生成NaClO2·3H2O晶体和温度过高产品分解。
(5)NaClO2~2I2~4S2O32-,该样品中NaClO2的质量分数为(0.02L×2.0mol·L-1)/4×90.5g/mol/1.00g=90.5%。