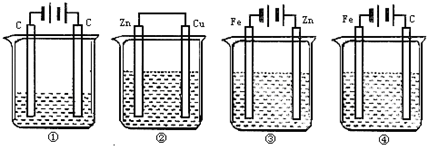
题目内容
如图所示,4种装置①盛 100mLCuSO4,②盛200mL 0.01mol/LH2SO4,③盛200mL ZnCl2,④盛200mL NaCl饱和溶液,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)( )
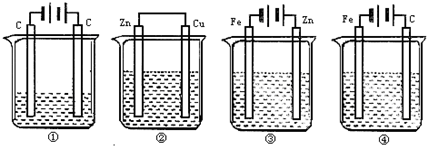

分析:①③④是电解池,②是原电池,①中析出铜和氧气,所以电解一段时间后,溶液中酸性增强,②中析出氢气,所以氢离子浓度降低,根据转移电子计算①②中氢离子浓度相对大小,比较酸性强弱,③是电镀池,pH不变,④中阴极上析出氢气,阳极上析出氯气,导致溶液的碱性增强.
解答:解:4个装置①是电解CuSO4,生成H2SO4转移0.02mol电子,生成c(H+)=0.002/0.1=0.02(mol/L),
②装置为原电池,在Cu板上有H2放出,2H++2e-=H2↑转移0.002mol电子,则消耗0.002molH+,溶液中剩余c(H+)=
mol/L=0.01mol/L,
③该装置实际上是一个电镀池,pH值不变,
④装置为电解NaCl饱和溶液,生成NaOH,pH值最大,所以正确的顺序为①②③④,
故选A.
②装置为原电池,在Cu板上有H2放出,2H++2e-=H2↑转移0.002mol电子,则消耗0.002molH+,溶液中剩余c(H+)=
| 0.2×0.01×2-0.002 |
| 0.2 |
③该装置实际上是一个电镀池,pH值不变,
④装置为电解NaCl饱和溶液,生成NaOH,pH值最大,所以正确的顺序为①②③④,
故选A.
点评:本题考查了原电池和电解池原理,明确阴阳极上放电的离子是解本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 选用下列试剂和电极:稀H2SO4、Fe 2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe 2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
 ;
;