题目内容
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+H2O(g) CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH2=CH2(g)+H2O(g)
 CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是| A.充入氦气 | B.分离除乙醇 | C.增大压强 | D.升高温度 |
C
试题分析:该反应是体积减小的放热的可逆反应,要使反应速率加快,同时乙烯的转化率提高,方法有升高温度,增大有气体参加的反应的压强等;提高乙烯的转化率,使反应向着正反应方向移动。A、充入氦气,如果容器容积不变,则反应速率不变。如果保持越强和温度不变,则容器容积增大,减小压强,根据勒夏特列原理,平衡向着逆向移动,乙烯转化率减小,且反应速率降低,故A错误;B、分离出乙醇,反应向着正向移动,乙烯转化率增大,但是反应速率降低,故B错误;C、由于增大了压强,反应速率增大,化学平衡向着正向移动,乙烯转化率增大,故C正确;D、升高了温度,反应速率增大,但是该反应是放热反应,平衡向着逆向移动,乙烯的转化率减小,故D错误,答案选C。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
 CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是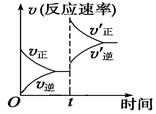
 xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)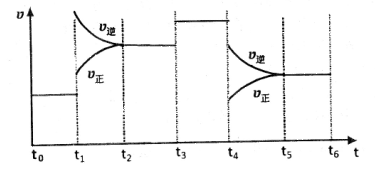
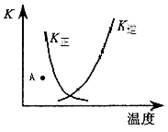
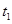 、
、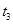 、
、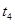 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化?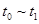 B.
B.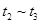 C.
C.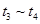 D.
D.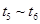
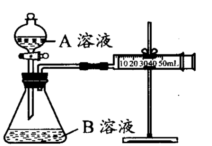
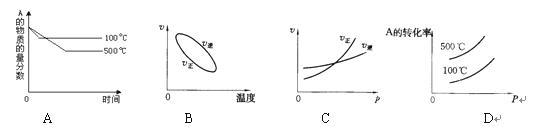
 2C(g)△H<0 的正确图象是下图中的( )
2C(g)△H<0 的正确图象是下图中的( )