题目内容
某烷烃A与炔烃B的混合气体1 mol的质量为25.6 g,取标准状况下的此混合气体6.72 L通入足量的溴水中,结果溴水质量增加4.8 g,由此推断A为________,B为__________.
【答案】
CH4 C3H4
【解析】
试题分析:混合气体的平均相对分子质量为25.6,最简单的炔烃C2 H2的相对分子质量为26,而烷烃中只有CH4的相对分子质量小于25.6.据平均相对分子质量的含义可知:混合气体中必有CH4.由于炔烃可与Br2发生加成反应,引起溴水增重,所以m(炔烃)=4.8 g
n(混合气体)=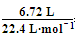 =0.3 mol
=0.3 mol
m(混合气体)=0.3 mol×25.6 g·mol-1=7.68 g
则n(CH4)=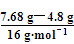 =0.18 mol
=0.18 mol
n(炔烃)=0.3 mol-0.18 mol=0.12 mol
炔烃的摩尔质量为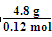 =40 g/mol
=40 g/mol
即14n-2=40,n=3,所以B为C3H4。
考点:考查有机物分子式的确定
点评:该题是中等难度的试题,试题在注重对学生基础性知识考查与训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的抽象思维能力和创新思维能力。该题的关键是得出混合物的平均相对分子质量,然后借助于数学上的平均值原理,并结合题意灵活运用即可。

练习册系列答案
相关题目