��Ŀ����
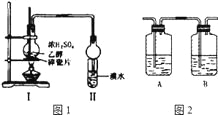
����Ŀ����ͼ��ʾװ�ý���̽��ʵ�飬����֤����������ϩ��������ϩ���в������ԡ����¶�Ѹ�������ɹ۲쵽�Թ�����ˮ��ɫ����ƿ��Ũ�������Ҵ��Ļ��Һ���Ϊ�غ�ɫ��
��1��д����ʵ����������ϩ�Ļ�ѧ����ʽ: _______
��2����ͬѧ��Ϊ:���ǵ��û��Һ�巴Ӧ�ĸ����ԣ���ˮ��ɫ��������֤����Ӧ������ϩ��������ϩ���в������ԣ���������ȷ���� ������ĸ��ţ�
A����ϩ����ˮ����ȡ����Ӧ B��ʹ��ˮ��ɫ�ķ�Ӧ,δ���Ǽӳɷ�Ӧ
C��ʹ��ˮ��ɫ������,δ������ϩ D��Ũ���������Ҵ�������ȩ,Ҳ��ʹ��ˮ��ɫ
��3����ͬѧ����ϸ�¹۲����Ϊ�Թ�����һ�����֤����Ӧ������ϩ���ɣ����������____________
��4����ͬѧ������ʵ��װ�ý����˸Ľ�����I��II֮��������ͼ2װ�ã���A�е��Լ�ӦΪ______________����������______________��B�е��Լ�Ϊ______________
��5����������ʵ�����ƿ�з�Һ����ȷ������ ������ĸ��ţ�
A����Һ��ȴ������ˮ����
B����Һ��ȴ����շ�Һ����
C����ˮ������ƿ��ϡ�ͺ����Һ�ף�
���𰸡���14�֣�
��1����![]()
��2����BC
��3����Һ������㣬�²�����״Һ��
��4����NaOH��Һ ����SO2Ʒ����Һ
��5����B
��������
���⣨1���Ҵ���Ũ����������¼��ȵ�170��������ȥ��Ӧ������ϩ����Ӧ�Ļ�ѧ����ʽΪCH3CH2OH![]() CH2=CH2��+H2O��
CH2=CH2��+H2O��
��2��A����ϩ����ˮ������ȡ����Ӧ��A�����B��ʹ��ˮ��ɫ�ķ�Ӧ��δ���Ǽӳɷ�Ӧ��B����ȷ�� C��Ũ���������ˮ�Ժ�ǿ�����ԣ��ܽ�C������CO2����Ũ����Ļ�ԭ�����Ƕ�������������Ҳ��ʹ��ˮ��ɫ����ʹ��ˮ��ɫ������,δ������ϩ����ȷ��D��Ũ�������л��ﷴӦ������ˮ�ԣ����������Ҵ�������ȩ,����ѡBC��
��3�������ϩ����ˮ�����ӳɷ�Ӧ����Ӧ����±������������±����������ˮ�����۲쵽Һ��ֲ㣬��״Һ�����²㣬֤������������ɣ�����Ӧ������ϩ���ɡ�
��4�����������������������NaOH��Һ��ȥ���ɣ�Ϊ�˼����Ƿ������B��Ӧ��ʢ��Ʒ����Һ������SO2�Ƿ����������A�е��Լ�ӦΪNaOH��Һ�������������ն�������B�е��Լ�ΪƷ����Һ��
��5��ʵ�����ƿ�з�Һ�к���Ũ���ᣬŨ�����ܶȴ���ˮ������ˮ���ȣ���Ũ������и�ʴ�ԣ������ȷ�Ĵ��������Ƿ�Һ��ȴ����շ�Һ���У���ѡB��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���״���һ�ֿ�������Դ����CO2�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ����CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=��49.58 kJmol��1
CH3OH(g)+H2O(g) ��H1=��49.58 kJmol��1
��Ӧ����CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ����CO(g)+2H2(g)![]() CH3OH(g) ��H3=��90.77 kJmol��1
CH3OH(g) ��H3=��90.77 kJmol��1
�ش��������⣺
(1)��Ӧ��ġ�H2=_________������Ӧ����������ƽ�ⳣ���ֱ�ΪK1��K2��K3����K2=________(��K1��K3��ʾ)��
(2)��Ӧ���Է�����������___________(�����ϵ��¶��������ϸ��¶��������κ��¶���)��
(3)��һ��������2 L�����ܱ������г���3 mol H2��1.5 mol CO2����������Ӧ��ʵ���ò�ͬ��Ӧ�¶�����ϵ��CO2��ƽ��ת���ʵĹ�ϵ�����±���ʾ��
�¶�(��) | 500 | T |
CO2��ƽ��ת���� | 60�G | 40�G |
��T______500��(����>������<�� ����=��)��
���¶�Ϊ500��ʱ���÷�Ӧ10 minʱ�ﵽƽ�⡣��H2��ʾ�÷�Ӧ�ķ�Ӧ����v(H2)=______________�����¶��£���ӦI��ƽ�ⳣ��K=______________L2/mol2
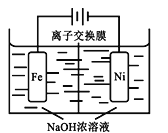
(4)��CO2�Ʊ��״�����Ҫ��������ҵ���õ�ⷨ��ȡNa2FeO4��ͬʱ���������Fe+2H2O+2OH![]() FeO42+3H2��������ԭ����ͼ��ʾ�����һ��ʱ���c(OH)���͵�������__________ (������������������������)�����ҷ����ĵ缫��ӦʽΪ��___________________________��
FeO42+3H2��������ԭ����ͼ��ʾ�����һ��ʱ���c(OH)���͵�������__________ (������������������������)�����ҷ����ĵ缫��ӦʽΪ��___________________________��