题目内容
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是 ( )。
| A.元素Z的氧化物一定属于碱性氧化物 |
| B.原子半径:X<Y<Z |
| C.三种元素中,Y的金属性最强 |
| D.Y、Z都能形成含氧酸,且前者的酸性比后者强 |
B
解析

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |
研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是
| A.比较这两种元素的单质的密度和熔点 |
| B.在氯化铝和氯化镁的溶液中分别滴加过量的氨水 |
| C.将空气中久置的镁带和铝片分别置于热水中,并滴入酚酞溶液 |
| D.用pH计分别测量相同物质的量浓度的氯化铝溶液和氯化镁溶液的pH |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的稳定性相比,前者较弱 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
下列有关物质的性质或结构的说法正确的是( )
| A.L层上的电子数为奇数的原子一定是主族元素的原子 |
| B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高 |
| C.化学键的形成一定伴随着电子的转移和能量变化 |
| D.元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于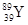 的说法不正确的是( )
的说法不正确的是( )
| A.属于金属元素 | B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 | D.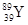 和 和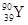 是两种不同的核素 是两种不同的核素 |
X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是( )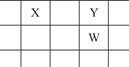
| A.5种元素中,原子半径最大的是W |
| B.Y与Z形成的化合物都可以和盐酸反应 |
| C.Y的简单阴离子比W的简单阴离子还原性强 |
| D.Z与Q形成的化合物水溶液一定显酸性 |
依据元素周期表及元素周期律,下列推断正确的是( )
| A.同周期主族元素的原子形成的简单离子电子层结构相同 |
| B.C比Si的原子半径小,CH4的稳定性比SiH4弱 |
| C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 |
| D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 |