题目内容
工业上可以利用废气中的CO2为原料制取甲醇。请回答下列问题:
(1) 已知常温常压下,下列两个可逆反应的能量变化如下图所示:

请写出左图反应的平衡常数表达式K= 。
请写出由二氧化碳和氢气制备甲醇的热化学方程式 。
(2) 如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应________(选填编号)。
A.一定向正反应方向移动 B.在平衡移动时,正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时,逆反应速率先减小后增大
(3) 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填字母)。
A.H2的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时,n(H2)/n(CH3OH)增大
(4) 保持温度和体积不变,通入1molCO2和3molH2 ,下列能说明该反应已达平衡状态的是________(填字母)。
,下列能说明该反应已达平衡状态的是________(填字母)。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CO2的消耗速率之比为3∶1
D.容器内气体的平均相对分子质量保持不变
(5) 若反应容器的容积为2.0 L,反应时间4.0 min,容器 内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
内气体的密度减少了2.0 g·L-1。在这段时间内CO2的平均反应速率为_______________
(6) 有人设计甲醇-空气燃料电池电源, 用石墨作电极电解200 mL含有下列离子的溶液:
用石墨作电极电解200 mL含有下列离子的溶液:
离子 | Cu2+ | H+ | Cl- | SO |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,标况下当两极收集到相同体积的气体时,阳极上收集到氧气的质量为____________(忽略溶液体积的变化及电极产物可能存在的溶解现象)。也有人用此电源利用电解法制备Na2FeO4,阳极材料为铁,其电解质溶液用NaOH溶液,阳极反应式为 。
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案用如图装置实验,下列预期实验现象及相应结论均正确的是
a | b | 预期实验现象 | 结论 |
| |
A | 铜丝 | 浓硝酸 | 试管C中有大量红棕色气体 | 硝酸有强氧化性 | |
B | 木条 | 18.4mol/L 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 | |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管C中有大量无色气体 | 该反应中铁作催化剂 |
下表是3种物质的溶解度(20℃),下列说法中正确的是( )
物质 | MgCl2 | Mg(OH)2 | MgCO3 |
溶解度(g/100g) | 74 | 0.000 84 | 0.01 |
A.已知MgCO3的Ksp=6.82×10﹣6 mol2·L﹣2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣),且c(Mg2+)·c(CO32﹣)=6.82×10﹣6 mol2·L﹣2
B.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有Mg2+和HCO3﹣的硬水,发生的离子反应方程式为Mg2++2HCO3﹣+Ca2++2OH﹣═CaCO3↓+MgCO3↓+2H2O




 )F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ___ ,F与BD之间的作用力为 ______ 。
)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ___ ,F与BD之间的作用力为 ______ 。


 O4溶液中投入Na:Cu2++2Na=Cu+2Na+
O4溶液中投入Na:Cu2++2Na=Cu+2Na+ +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O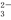 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的
、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的 关系图正确的是 ( )
关系图正确的是 ( )