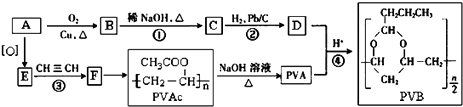
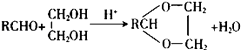题目内容
【题目】一定条件下,向密闭恒容容器中加入1.0mol/L X,发生反应:2X(g)Y(g)+Z(g),△H<0,反应到8min时达到平衡;在14min时改变的温度,16min时建立新平衡.X的物质的量浓度变化如图所示.下列有关说法正确的是( ) 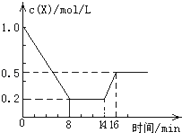
A.0~8min用Y表示的该反应的速度为0.1mol/Lmin
B.8min时达到平衡,该反应的平衡常数为 K=0.5
C.14min时,改变的反应条件是降低了体系的温度
D.16min时的正反应速率,比8min时的正反应速率大
【答案】D
【解析】解:A.由图可知,0~8min内X的浓度变化量为1mol/L﹣0.2mol/L=0.8mol/L,故v(X)= ![]() =0.1mol/(Lmin),根据速率之比等于化学计量数之比,则v(Y)=
=0.1mol/(Lmin),根据速率之比等于化学计量数之比,则v(Y)= ![]() v(X)=
v(X)= ![]() ×0.1mol/(Lmin)=0.05mol/(Lmin),故A错误;
×0.1mol/(Lmin)=0.05mol/(Lmin),故A错误;
B.由图可知,0~8min内X的浓度变化量为1mol/L﹣0.2mol/L=0.8mol/L,则:
2X(g) | Y(g)+ | Z(g) | ||
开始(mol/L) | 1 | 0 | 0 | |
变化(mol/L) | 0.8 | 0.4 | 0.4 | |
平衡(mol/L) | 0.2 | 0.4 | 0.4 |
故该温度下平衡常数k= ![]() =4,故B错误;
=4,故B错误;
C.由图可知,14min时瞬间X的浓度不变,不可能为改变压强,改变条件X的浓度增大,该反应正反应是放热反应,可能为升高温度或增大生成物的物质的量,故C错误;
D.由C分析可知,14min时改变条件为升高温度或增大生成物的物质的量,反应速率加快,故16min平衡时正、逆速率都高于8min时,故D正确;
故选D.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).

【题目】高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].图1是实验室模拟制备的操作流程: 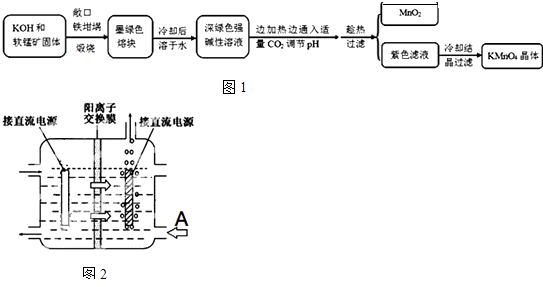
相关资料:
①物质溶解度
物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42﹣)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42﹣会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是;
(2)实验时,若CO2过量会生成KHCO3 , 导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:;
其中氧化还原反应中氧化剂和还原剂的质量比为 .
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中 , 得到的产品纯度更高.
A.醋酸
B.浓盐酸
C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为 . 使用阳离子交换膜可以提高Mn元素利用率的原因为 .